��Ŀ����
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�ã���1��N2H4�е�Nԭ�������ﵽ8�����ȶ��ṹ��д��N2H4�Ľṹʽ
��2��NH3��NaClO��Ӧ�ɵõ��£�N2H4�����÷�Ӧ�Ļ�ѧ����ʽΪ
��3������һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ��д����ȼ�յ��Ȼ�ѧ����ʽ
���ĺϳ�������Ҫ�Ļ�������֮һ����֪��
N2��g��+3H2��g��?2NH3��g����H=-92.4kJ?mol-1
��3�������Ϊ2L���ܱ������У�����ͬ���¶��£�ʹ����ͬ�Ĵ����ϳɰ���ʵ���÷�Ӧ����ʼ���ﵽƽ��ʱ���й��������±���ʾ��
| �ݡ��� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3mol��H2��2mol��N2 | 6mol��H2��4mol��N2 | 2mol��NH3 |
| �ﵽƽ���ʱ�䣨min�� | 5 | 8 | |
| N2��Ũ�ȣ�mol?L�� | c1 | 1.5 | |
| NH��������� | ��1 | ��2 | ��3 |
| ��������ܶȣ�g?L�� | ��1 | ��2 |
��1�����и�����˵���÷�Ӧ�Ѵﵽƽ��״̬����
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v��N2����=3v��H2����
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
��2�������ϱ����ݣ����й�ϵ��ȷ����
A��2c1��1.5mol?L-1 B��w3=w1 C��2��1=��2 D��K��=K��=K��
��3���������з�Ӧ�ӿ�ʼ����ƽ��ƽ������Ϊv��H2��=
��ֱ�ӹ���ʽ����ȼ�ϵ�صĵ�ط�Ӧʽ��4NH3+3O2�T2N2+6H2O���������Һһ��ʹ��KOH��Һ�����缫��Ӧʽ��
���㣺��Чƽ��,��Ӧ�Ⱥ��ʱ�,��ѧ��Դ���͵��,��ѧƽ��״̬���ж�
ר�⣺�����������������
��������1�����ݵ�ԭ������������Ϊ3�����γ�3�����ۼ������γ�8���ӽṹ�����ݽṹʽ��д����д����
��2������������ԭ��Ӧ�����غ�����жϲ������ƽ��ѧ����ʽ��
��3�����ݸ�˹���ɿ���÷�Ӧ�ȣ���д���Ȼ�ѧ����ʽ��
��1���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�Դ��жϣ�
��2���Ƚ����е����ݰ��ջ�ѧ������ת���ɷ�Ӧ�ﵪ�������������ʵ�����Ȼ�����õ�Чƽ��֪ʶ���з�����
��3���ȼ�����õ�����ʾ�ķ�Ӧ���ʣ�Ȼ�����û�ѧ��������ϵ�������������ʾ�ķ�Ӧ���ʣ�
����Ϊ�������壬�������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
��2������������ԭ��Ӧ�����غ�����жϲ������ƽ��ѧ����ʽ��
��3�����ݸ�˹���ɿ���÷�Ӧ�ȣ���д���Ȼ�ѧ����ʽ��
��1���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�Դ��жϣ�
��2���Ƚ����е����ݰ��ջ�ѧ������ת���ɷ�Ӧ�ﵪ�������������ʵ�����Ȼ�����õ�Чƽ��֪ʶ���з�����
��3���ȼ�����õ�����ʾ�ķ�Ӧ���ʣ�Ȼ�����û�ѧ��������ϵ�������������ʾ�ķ�Ӧ���ʣ�
����Ϊ�������壬�������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
���
�⣺��1��N2H4�е�Nԭ�ӿɴﵽ8���ӵ��ȶ��ṹ����ԭ�������3�������γ����Թ��õ��Ӷԣ���δ�ɼ���һ�Ե����γ�8�����ȶ��ṹ��ÿ����ԭ�Ӻ�������ԭ���γɹ��ۼ�����ԭ�Ӽ��γ�һ�����ۼ����ṹʽΪ��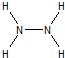 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��NH3��NaClO��Ӧ�ɵõ��£�N2H4������Ԫ�ػ��ϼ����߱���������������������������ԭΪ�Ȼ��ƣ�����ԭ���غ���ƽд����ѧ����ʽΪ2NH3+NaClO=N2H4+NaCl+H2O��
�ʴ�Ϊ��2NH3+NaClO=N2H4+NaCl+H2O��
��3����ͼ��֪���ڷ�Ӧ N2H4��g��+O2��g���TN2��g��+2H2O��g���С�H=2218kJ?mol-1-2752kJ?mol-1=-534 kJ?mol-1�������Ȼ�ѧ����ʽΪ��N2 H4��g��+O2��g��=N2��g��+2H2O��g ����H=-534 kJ?mol-1���ʴ�Ϊ��N2 H4��g��+O2��g��=N2��g��+2H2O��g ����H=-534 kJ?mol-1��
��1��a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2������˵���ﵽ�ж�״̬��ȡ������ʼ���ϱȺ�ת���̶ȣ���a����
b����3v��N2����=v��H2����ʱ����˵���ﵽƽ��״̬����b����
c��������ѹǿ���ֲ��䣬��˵���ﵽƽ��״̬����c��ȷ��
d������ʱ������䣬�������䣬����������ܶȱ��ֲ��䣬���ܴﵽƽ��״̬����d����
�ʴ�Ϊ��c��
��2�����¡����������£�
A���������������ݻ�Ϊ4L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c1=1.5mol/L������ѹǿ����ƽ�����������ƶ���������Ũ����������2c1��1.5mol/L����A��ȷ��
B������2mol�����൱�ڼ�����1mol������3mol������������Ϊ3mol H2��2mol N2�����ڱ���Ӧ�ﵪ�������ʵ�����С�����ɵİ��������ʵ�����С�����Ԧ�3����1����B����
C����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2����������=
��֪��2��1=��2����C��ȷ��
D����Ϊ�¶���ͬ����K��=K��=K������D��ȷ��
��ѡACD��
��3���������У���Ӧǰ������Ũ��Ϊ��
=2mol/L��������ƽ����Ӧ����Ϊ��v��N2��=
=0.1mol?L-1?min-1�����ݷ�Ӧ3H2��g��+N2��g��?2NH3��g����֪��v��H2��=3v��N2��=0.3 mol?L-1?min-1���ʴ�Ϊ��0.3 mol?L-1?min-1��
����Ϊ�������壬�������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O���ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����2��NH3��NaClO��Ӧ�ɵõ��£�N2H4������Ԫ�ػ��ϼ����߱���������������������������ԭΪ�Ȼ��ƣ�����ԭ���غ���ƽд����ѧ����ʽΪ2NH3+NaClO=N2H4+NaCl+H2O��
�ʴ�Ϊ��2NH3+NaClO=N2H4+NaCl+H2O��
��3����ͼ��֪���ڷ�Ӧ N2H4��g��+O2��g���TN2��g��+2H2O��g���С�H=2218kJ?mol-1-2752kJ?mol-1=-534 kJ?mol-1�������Ȼ�ѧ����ʽΪ��N2 H4��g��+O2��g��=N2��g��+2H2O��g ����H=-534 kJ?mol-1���ʴ�Ϊ��N2 H4��g��+O2��g��=N2��g��+2H2O��g ����H=-534 kJ?mol-1��
��1��a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2������˵���ﵽ�ж�״̬��ȡ������ʼ���ϱȺ�ת���̶ȣ���a����
b����3v��N2����=v��H2����ʱ����˵���ﵽƽ��״̬����b����
c��������ѹǿ���ֲ��䣬��˵���ﵽƽ��״̬����c��ȷ��
d������ʱ������䣬�������䣬����������ܶȱ��ֲ��䣬���ܴﵽƽ��״̬����d����
�ʴ�Ϊ��c��
��2�����¡����������£�
A���������������ݻ�Ϊ4L����ﵽƽ��ʱ����Ϊ��Чƽ�⣬����ֵĺ�����Ũ����ȣ���ʱ������Ũ��Ϊc1��Ȼ���������ݻ���С��2L����ƽ�ⲻ�ƶ���2c1=1.5mol/L������ѹǿ����ƽ�����������ƶ���������Ũ����������2c1��1.5mol/L����A��ȷ��
B������2mol�����൱�ڼ�����1mol������3mol������������Ϊ3mol H2��2mol N2�����ڱ���Ӧ�ﵪ�������ʵ�����С�����ɵİ��������ʵ�����С�����Ԧ�3����1����B����
C����Ӧǰ�������壬�������ݻ�����2L�����л�����������Ϊ��2����������=
| m |
| V |
D����Ϊ�¶���ͬ����K��=K��=K������D��ȷ��
��ѡACD��
��3���������У���Ӧǰ������Ũ��Ϊ��
| 4mol |
| 2L |
| 2mol/L-1.5mol/L |
| 5min |
����Ϊ�������壬�������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O���ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
���������⿼���˻�ѧƽ���Ӱ�����ط�������ѧ��Ӧ���ʵ�Ӱ�������жϡ���ѧ��Ӧ���ʵļ����֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧƽ���Ӱ�����ء���ѧ��Ӧ���ʵļ��㷽�����ܹ����ø�˹�������㷴Ӧ�е��ʱ䣮

��ϰ��ϵ�д�
�����Ŀ
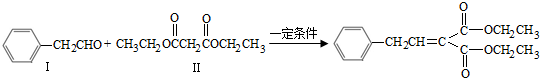
 �ɺϳɻ�����I�����������
�ɺϳɻ�����I����������� ��ͬ���칹�壬���ĺ˴Ź�������������壬�����֮��Ϊ4��6������CrO-�������·�Ӧ����������������Ӧ�Ļ�����V�����Ľṹ��ʽΪ
��ͬ���칹�壬���ĺ˴Ź�������������壬�����֮��Ϊ4��6������CrO-�������·�Ӧ����������������Ӧ�Ļ�����V�����Ľṹ��ʽΪ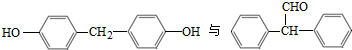 Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ������ĽṹʽΪ
Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ������ĽṹʽΪ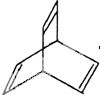 I���л���Ľṹ���á�����ʽ����ʾ��CH3-CH=CH-CH3�ɼ�д
I���л���Ľṹ���á�����ʽ����ʾ��CH3-CH=CH-CH3�ɼ�д Ϊ���л���X�ļ���ʽ��ͼ��
Ϊ���л���X�ļ���ʽ��ͼ�� ����û�����Ľṹ��ʽ�����ǣ���
����û�����Ľṹ��ʽ�����ǣ���