题目内容
H2S分子中共价键键角接近90°,说明分子的空间立体结构为 ;CO2分子中的共价键键角为180°,说明分子的空间立体结构为 ;NH3分子中共价键键角为107°,说明分子的空间立体结构为 .
考点:判断简单分子或离子的构型
专题:原子组成与结构专题
分析:键角是描述共价键分子空间立体结构的重要参数,键角反映了分子中原子在空间的伸展方向,分子构型是由键角决定的.
解答:
解:H2S分子中共价键键角接近90°,即H-S-S键角接近90°,空间构型为V形;CO2分子中的共价键键角为180°,O=C=O键角为180°,形成直线,分子构型为直线形;NH3分子中共价键键角为107°,N原子位于顶点,三个H原子与N原子形成三角锥形,
故答案为:V形;直线形;三角锥.
故答案为:V形;直线形;三角锥.
点评:学会用键角直接判断分子的空间立体结构,应熟记不同的键角决定的分子的空间构型.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
分子式为C7H16,主链上为五个碳原子的有机物共有( )
| A、2种 | B、3种 | C、5种 | D、7种 |
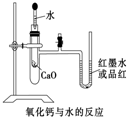 如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置
如图是某同学设计的放热反应的观察装置.其实验顺序是:①按图所示将实验装置 氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.