题目内容
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.
(1)Q、W、X、Y原子半径由大到小的顺序是: (用元素符号表示);
(2)Q和Z所形成的原子个数比为1:2的化合物的化学式为 ,分子空间构型为 ;
(3)由X、Y和W三种元素形成的某化合物的水溶液呈 性(填“酸、碱或中”);并用离子方程式表示原因 .
(1)Q、W、X、Y原子半径由大到小的顺序是:
(2)Q和Z所形成的原子个数比为1:2的化合物的化学式为
(3)由X、Y和W三种元素形成的某化合物的水溶液呈
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的焰色呈黄色,应为Na元素;X、Y是金属元素,且原子序数依次增大的短周期元素、工业上一般通过电解氧化物的方法获得Y的单质,则Y应为Al元素;W、Z最外层电子数相同,应为同主族元素,Z的核电荷数是W的2倍,可知W为O元素,Z为S元素;五种元素核电荷数之和为54,则Q的原子序数为:54-8-16-11-13=6,应为C元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:X的焰色呈黄色,应为Na元素;X、Y是金属元素,且原子序数依次增大的短周期元素、工业上一般通过电解氧化物的方法获得Y的单质,则Y应为Al元素;W、Z最外层电子数相同,应为同主族元素,Z的核电荷数是W的2倍,可知W为O元素,Z为S元素;五种元素核电荷数之和为54,则Q的原子序数为:54-8-16-11-13=6,应为C元素,
(1)由以上分析可知Q、W、X、Y分别为C、O、Na、Al,原子半径大小关系为Na>Al>C>O,
故答案为:Na>Al>C>O;
(2)Q和Z所形成的化合物为CS2,其结构类型于二氧化碳,分子空间构成为直线形,
故答案为:CS2;直线形;
(3)X、Y和W三种元素形成的化合物NaAlO2,为强碱弱酸盐,水解呈碱性,水解的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:碱;AlO2-+2H2O?Al(OH)3+OH-.
(1)由以上分析可知Q、W、X、Y分别为C、O、Na、Al,原子半径大小关系为Na>Al>C>O,
故答案为:Na>Al>C>O;
(2)Q和Z所形成的化合物为CS2,其结构类型于二氧化碳,分子空间构成为直线形,
故答案为:CS2;直线形;
(3)X、Y和W三种元素形成的化合物NaAlO2,为强碱弱酸盐,水解呈碱性,水解的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:碱;AlO2-+2H2O?Al(OH)3+OH-.
点评:本题考查位置、结构与性质的关系,题目难度中等,明确元素的种类为解答该题的关键,注意把握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
用如图所示装置进行实验,装置正确且设计合理的是( )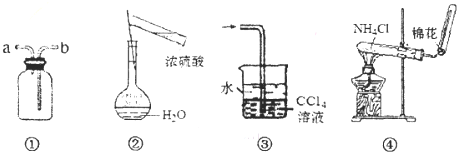

| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
某原电池的总反应离子方程为Fe+Cu2+=Fe2++Cu不能实现该反应的原电池是( )
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |