题目内容
3.安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,(1)请写出基态Cu原子的外围电子排布式3d104s1.焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了跃迁而变为激发态.
(2)新型农药松脂酸铜具有低残留的特点,图1是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数6;加“*”碳原子的杂化方式为sp3.
(3)图2是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)Cu2X;与X等距离且最近的X原子个数为8
(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型V形,比较第一电离能:S<O(填“>”或“<”)
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞
 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
分析 (1)Cu原子核外电子数为29,根据能量最低原理书写外围电子排布式;基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色;
(2)单键为σ键,双键含有1个σ键、1个π键;加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(3)根据均摊法计算晶胞中Cu原子、X原子数目,进而确定化学式;体心X原子与晶胞顶点的X原子距离最近;
(4)计算S原子孤对电子、价层电子对数确定其空间结构,同主族自上而下第一电离能减小;
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}c{m}^{3}$,所以晶胞的边长为:$\root{3}{\frac{257}{8.5{N}_{A}}}$cm.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理,外围电子排布式为:3d104s1,基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色,
故答案为:3d104s1;跃迁;
(2)1个松脂酸铜中含有个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,
故答案为:6;sp3;
(3)晶胞中Cu原子数目为4,X原子数目为1+8×$\frac{1}{8}$=2,故化学式为Cu2X,体心X原子与晶胞顶点的X原子距离为晶胞棱长的$\frac{\sqrt{3}}{2}$倍,而位于面心对角线X原子之间距离为棱长的$\sqrt{2}$倍,故体心X原子与晶胞顶点的X原子距离最近,X原子配位数为8,
故答案为:Cu2X;8;
(4)S原子孤对电子数为$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O,
故答案为:V形;<.
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}c{m}^{3}$,所以晶胞的边长为:$\root{3}{\frac{257}{8.5{N}_{A}}}$cm,故答案为:$\root{3}{\frac{257}{8.5{N}_{A}}}$cm.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算、电离能等,难度不大,掌握利用均摊法进行晶胞计算,注意同周期第一电离能异常情况.

| A. | b>a>c | B. | c>a>b | C. | a>b>c | D. | a=b=c |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
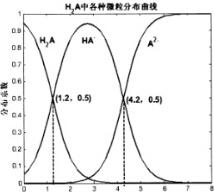 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(3)气态氢化物溶于水呈碱性的化合物是NH3(填化学式).
(4)⑩号元素最低正价含氧酸只具有共价键.
(5)①⑤⑦形成的化合物中,既含有离子键,又含有共价键,写出该化合物的化学式NaOH.
(6)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,气态氢化物的化学式为H2S,该元素与③形成的化合物的化学式为CS2,含有的化学键为共价键.
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②
下列说法中正确的是( )
| A. | 在400℃时,反应①未达平衡,反应②达到平衡 | |
| B. | 800℃后再升高温度,反应①的平衡逆向移动;反应②的平衡正向移动 | |
| C. | 加压可提高NH3生成NO的转化率 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=-181.5 kJ•mol-1 |
 现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.
现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.