题目内容
11.鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个 C=C且不含环状结构,则其分子式为( )| A. | C30H50 | B. | C30H56 | C. | C36H72 | D. | C30H60 |
分析 烃中每含有1个C=C键,则减少2个H原子,6个碳碳双键会减少12个H,根据含30个碳原子的烷烃其分子式为C30H62进行判断该有机物的分子式.
解答 解:含30个碳原子的烷烃其分子式为C30H62,当分子中含有6个C=C而不含环状结构时,氢原子数减少12个,所以角鲨烯的分子式为:C30H50,
故选A.
点评 本题考查有机物分子式的确定,题目难度不大,明确C=C键的个数与H原子的关系为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.常温下体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( 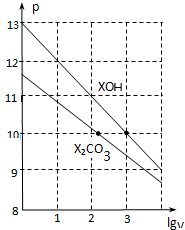

| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
16. 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.
(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是AD
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是A(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)X-+H2O?HX+OH-.
②下列说法不正确的是b(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m<n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
1.能正确表示下列化学反应的离子方程式的是( )
| A. | 醋酸与氢氧化钠反应:H++OH-═H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 碳酸钠与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O |
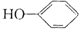 合成
合成 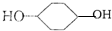
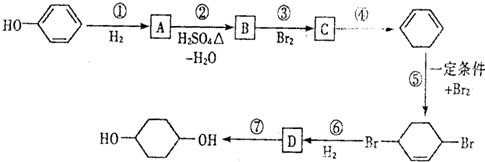
 ,D
,D .
.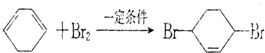 写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式
写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式 .
. 的反应方程式(有机物写结构简式,注明反应条件).
的反应方程式(有机物写结构简式,注明反应条件). .
.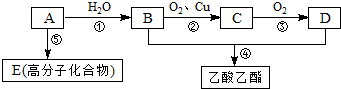
 .
. 是一种抗氧化药物,存在如图所示的转化关系.
是一种抗氧化药物,存在如图所示的转化关系.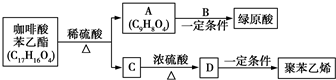
 .
.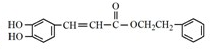 .
. (任写1个).
(任写1个).