题目内容
6.为了测定某铜银合金的成分,将30.0g合金溶于80mL 13.5mol/L的浓硝酸中,待合金完全溶解后,共收集到标准状况气体6.72L,并测得溶液的c(H+)=1mol/L,假设反应后溶液的体积仍为80mL,计算:(1)被还原的硝酸的物质的量.
(2)合金中银的质量分数.
(3)NO和NO2体积.
分析 (1)被还原的硝酸生成NO、NO2,根据N元素守恒计算被还原硝酸的物质的量;
(2)令混合物中Cu、Ag物质的量分别为xmol、ymol,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算Ag的质量;
(3)令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒列方程计算,进而计算一氧化氮和二氧化氮的体积.
解答 解:(1)收集到的气体为NO2和NO,故被还原的n(HNO3)=n(NO2+NO)=6.72 L÷22.4L•mol-1=0.30mol,
答:被还原的硝酸的物质的量为0.3mol;
(2)反应的n(HNO3)=13.5 mol•L-1×0.08L-1.0 mol•L-1×0.08L=1 mol
设合金中铜、银物质的量分别为xmol、ymol,则:
64x+108y=30 ①
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x mol、y mol,据N守恒可得:
2x+y+0.3=1 ②
联立①②,解得x=0.3 y=0.10 mol
故合金中银的质量=0.10 mol×108g/mol=10.8g,合金中银的质量分数为:$\frac{10.8g}{30g}×100%$=36%,答:合金中银的质量分数为36%;
(3)令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒,则:
$\left\{\begin{array}{l}{a+b=\frac{6.72}{22.4}}\\{3a+b=0.3×2+0.1×1}\end{array}\right.$
解得a=0.2,b=0.1
故混合气体中NO2的体积=0.1mol×22.4L/mol=2.24L,V(NO)=4.48L,
答:NO和NO2体积分别是:4.48L和2.24L.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意守恒思想的应用.

 智慧小复习系列答案
智慧小复习系列答案| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
(1)C的最低价氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):H2O>CH4
(2)元素E在周期表中的位置为第三周期VIIA族
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:NH4+和OH-
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(5)写出甲的电子式:
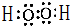
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol•L-1 NaOH 溶液的体积是:80mL.
| A. | 硫酸铁溶液 | B. | 浓硝酸 | C. | 盐酸 | D. | 硫酸铜溶液 |
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①与③按原子个数1:2构成的分子的电子式为
 .
.(3)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
| A. | C30H50 | B. | C30H56 | C. | C36H72 | D. | C30H60 |
| A. | 氯化钠 | B. | 铜 | C. | 氢氧化钠溶液 | D. | 乙醇 |
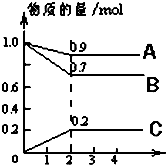 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析: