题目内容
化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数.
甲方案:
实验步骤为:①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③加热;④冷却;⑤称量坩埚和残余物的质量为m3 g;⑥重复③至⑤操作,直至恒重,质量为m4g.
(1)坩埚中发生反应的化学方程式为 .
(2)计算Na2CO3质量分数必须用到的测定数据为 .
乙方案:
在天平上准确称取0.3200g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.100 0mol?L-1的标准盐酸滴定至溶液由粉红色刚好变为无色(发生的反应为H++CO32-=HCO3-).重复上述操作两次.
(3)根据下表数据,样品中w(Na2CO3)= .
(4)如果滴定后俯视读数,w(Na2CO3) (填“偏高”、“偏低”或“不受影响”).
丙方案:称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积.
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若分液漏斗中的水无法持续滴下,试判断装置A是否漏气? (填“漏气”、“不漏气”或“无法确定”).
(6)为了提高测定的准确性,应选用装置A和 (填写字母标号)进行实验.
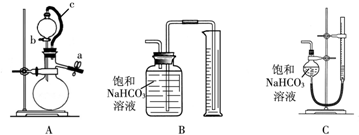
(7)实验时还需要知道的物理量是 .
甲方案:
实验步骤为:①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③加热;④冷却;⑤称量坩埚和残余物的质量为m3 g;⑥重复③至⑤操作,直至恒重,质量为m4g.
(1)坩埚中发生反应的化学方程式为
(2)计算Na2CO3质量分数必须用到的测定数据为
乙方案:
在天平上准确称取0.3200g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.100 0mol?L-1的标准盐酸滴定至溶液由粉红色刚好变为无色(发生的反应为H++CO32-=HCO3-).重复上述操作两次.
(3)根据下表数据,样品中w(Na2CO3)=
| 滴定 次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.320 0 | 1.02 | 21.03 |
| 2 | 0.320 0 | 2.00 | 21.99 |
| 3 | 0.320 0 | 0.20 | 20.20 |
丙方案:称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积.
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b.若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?
(6)为了提高测定的准确性,应选用装置A和

(7)实验时还需要知道的物理量是
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:几种重要的金属及其化合物
分析:(1)Na2CO3与NaHCO3混合物中碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
(2)依据加热反应过程中反应前后质量变化计算碳酸氢钠得到碳酸钠质量计算碳酸钠质量分数;
(3)滴定实验利用酚酞指示终点,发生的反应为:H++CO32-=HCO3-,结合图表数据计算平均值,依据反应定量关系计算得到碳酸钠物质的量,计算得到碳酸钠质量分数;
(4)如果滴定后俯视读数读取盐酸溶液体积减小,计算得到碳酸钠质量减小,质量分数偏低;
(5)题干的检查方法有个漏洞 就是c夹子向左一直到分液漏斗的液面这段装置气密性是没有被检验的,如果这段漏气水照样不会流下来,故这段装置既可以气密性良好,也可以漏气 即装置A既可以气密性良好,也可以漏气;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确;
(7)测定气体体积需要温度压强或标准状况气体摩尔体积,或气体密度,计算得到;
(2)依据加热反应过程中反应前后质量变化计算碳酸氢钠得到碳酸钠质量计算碳酸钠质量分数;
(3)滴定实验利用酚酞指示终点,发生的反应为:H++CO32-=HCO3-,结合图表数据计算平均值,依据反应定量关系计算得到碳酸钠物质的量,计算得到碳酸钠质量分数;
(4)如果滴定后俯视读数读取盐酸溶液体积减小,计算得到碳酸钠质量减小,质量分数偏低;
(5)题干的检查方法有个漏洞 就是c夹子向左一直到分液漏斗的液面这段装置气密性是没有被检验的,如果这段漏气水照样不会流下来,故这段装置既可以气密性良好,也可以漏气 即装置A既可以气密性良好,也可以漏气;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确;
(7)测定气体体积需要温度压强或标准状况气体摩尔体积,或气体密度,计算得到;
解答:
解:(1)Na2CO3与NaHCO3混合物中碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,坩埚中发生反应的化学方程式为:2NaHCO3
Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(2)①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③加热;④冷却;⑤称量坩埚和残余物的质量为m3 g;⑥重复③至⑤操作,直至恒重,质量为m4g.
依据计算方法分析,需要的数值为:①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③;③加热;④冷却,称量至恒重得到反应后固体质量,则反应前后质量差为(m2-m1-m4),结合反应2NaHCO3
Na2CO3+H2O+CO2↑,前后固体质量差计算混合物中碳酸氢钠的质量,碳酸钠质量为m2-m1-碳酸氢钠质量,计算得到碳酸钠质量质量分数,所以需要数值为m1、m2和m4;
故答案为:m1、m2和m4;
(3)图表数据中平均消耗盐酸体积=
ml=20ml
H++CO32-=HCO3-,
0.020L×0.100mol/L 0.002mol
m(Na2CO3)=0.002mol×106g/mol=0.212g
碳酸钠质量分数=
×100%=66.25%;
故答案为:66.25%;
(4)如果滴定后俯视读数读取盐酸溶液体积减小,计算得到碳酸钠质量减小,质量分数偏低;
故答案为:偏低;
(5)题干的检查方法有个漏洞 就是c夹子向左一直到分液漏斗的液面这段装置气密性是没有被检验的,如果这段漏气水照样不会流下来,故这段装置既可以气密性良好,也可以漏气 即装置A既可以气密性良好,也可以漏气,所以气密性无法确定;
故答案为:无法确定;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确,应选择AC装置进行测定;
故答案为:C;
(7)实验依据是测定样品与硫酸反应生成的气体体积,测定气体体积需要温度压强或标准状况气体摩尔体积,或气体密度,计算得到二氧化碳的物质的量来计算碳酸钠质量计算得到碳酸钠质量分数;
故答案为:该条件下CO2气体的密度,或实验时的温度与压强,或该条件下的气体摩尔体积等;
| ||
故答案为:2NaHCO3
| ||
(2)①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③加热;④冷却;⑤称量坩埚和残余物的质量为m3 g;⑥重复③至⑤操作,直至恒重,质量为m4g.
依据计算方法分析,需要的数值为:①称量空坩埚的质量为m1 g;②称量装有试样的坩埚质量为m2g;③;③加热;④冷却,称量至恒重得到反应后固体质量,则反应前后质量差为(m2-m1-m4),结合反应2NaHCO3
| ||
故答案为:m1、m2和m4;
(3)图表数据中平均消耗盐酸体积=
| 21.03-1.02+21.99-2.00+20.20-0.20 |
| 3 |
H++CO32-=HCO3-,
0.020L×0.100mol/L 0.002mol
m(Na2CO3)=0.002mol×106g/mol=0.212g
碳酸钠质量分数=
| 0.212g |
| 0.32g |
故答案为:66.25%;
(4)如果滴定后俯视读数读取盐酸溶液体积减小,计算得到碳酸钠质量减小,质量分数偏低;
故答案为:偏低;
(5)题干的检查方法有个漏洞 就是c夹子向左一直到分液漏斗的液面这段装置气密性是没有被检验的,如果这段漏气水照样不会流下来,故这段装置既可以气密性良好,也可以漏气 即装置A既可以气密性良好,也可以漏气,所以气密性无法确定;
故答案为:无法确定;
(6)为了提高测定的准确性,测量气体体积应选用量气管更准确,应选择AC装置进行测定;
故答案为:C;
(7)实验依据是测定样品与硫酸反应生成的气体体积,测定气体体积需要温度压强或标准状况气体摩尔体积,或气体密度,计算得到二氧化碳的物质的量来计算碳酸钠质量计算得到碳酸钠质量分数;
故答案为:该条件下CO2气体的密度,或实验时的温度与压强,或该条件下的气体摩尔体积等;
点评:本题考查了物质组成的 实验探究和实验测定方法分析判断,主要是实验基本操作和物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
只用一种试剂就能将NH4Cl、NaCl、AlCl3、MgCl2四种无色透明溶液区别出来,这种试剂可以是( )
| A、氨水 | B、氯化钙溶液 |
| C、氢氧化钠溶液 | D、稀硫酸 |
关于有机物结构、性质、鉴别的叙述正确的是( )
| A、淀粉和纤维素都是多糖,其分子式为 (C6H10O5)n |
| B、乙烯和苯都能使溴水褪色,故不能用溴水鉴别乙烯和苯蒸气 |
| C、NH4Cl可以使蛋白质变性形成沉淀从溶液中析出 |
| D、苯与酸性KMnO4溶液混合振荡、静置分层,下层液体为无色 |
金属镁的密度较小,镁合金的强度高、机械性能好,是制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉.从化学原理和经济效益角度分析,下列海水中提取镁的方法最合理的是( )
A、海水
| |||||||||||
B、海水
| |||||||||||
C、海水
| |||||||||||
D、海水
|
关于如图所示的原电池,下列说法正确的是( )
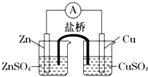

| A、锌是电池的负极,发生还原反应 |
| B、盐桥中的阳离子向硫酸铜溶液中迁移 |
| C、电流从锌电极通过检流计流向铜电极 |
| D、铜电极上发生的电极反应是2H++e-=H2↑ |


 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)