题目内容
对于0.1mol?L-1 Na2SO3溶液,正确的是( )
| A、升高温度,溶液的pH降低 |
| B、[Na+]=2[SO32-]+[HSO3-]+[H2SO3] |
| C、[Na+]+[H+]=2[SO32-]+2[HSO3-]+[OH-] |
| D、加入少量NaOH固体,[SO32-]与[Na+]均增大 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、升高温度,会促进亚硫酸根离子的水解,溶液中氢氧根离子浓度增大;
B、溶液中一定满足物料守恒,根据溶液中的物料守恒知识分析;
C、溶液中一定遵循电荷守恒,根据溶液中的电荷守恒判断;
D、根据盐的水解原理及其影响因素进行判断.
B、溶液中一定满足物料守恒,根据溶液中的物料守恒知识分析;
C、溶液中一定遵循电荷守恒,根据溶液中的电荷守恒判断;
D、根据盐的水解原理及其影响因素进行判断.
解答:
解:0.1mol?L-1 Na2SO3溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,该过程是吸热过程,
A、升高温度,水解平衡向着正向移动,促进了亚硫酸根离子的水解,所以溶液的pH升高,故A错误;
B、溶液中存在物料守恒:[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],故B错误;
C、亚硫酸钠溶液中存在电荷守恒:[Na+]+[H+]=2[SO32-]+[HSO3-]+[OH-],故C错误;
D、加入少量NaOH固体,水解平衡SO32-+H2O?HSO3-+OH-向逆反应方向移动,所以c(SO32-)与c(Na+)均增大,故D正确;
故选D.
A、升高温度,水解平衡向着正向移动,促进了亚硫酸根离子的水解,所以溶液的pH升高,故A错误;
B、溶液中存在物料守恒:[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3],故B错误;
C、亚硫酸钠溶液中存在电荷守恒:[Na+]+[H+]=2[SO32-]+[HSO3-]+[OH-],故C错误;
D、加入少量NaOH固体,水解平衡SO32-+H2O?HSO3-+OH-向逆反应方向移动,所以c(SO32-)与c(Na+)均增大,故D正确;
故选D.
点评:本题考查了离子浓度大小比较、盐的水解原理及其影响,题目难度中等,注意掌握盐的水解原理及其影响因素,明确电荷守恒、物料守恒的含义及其在判断溶液中离子浓度大小中的应用方法.

练习册系列答案
相关题目
现加热5.00g NaHCO3和Na2CO3的混合物,使NaHCO3完全分解,产生标况下CO2气体体积为224ml,则原混合物中Na2CO3的质量为( )
| A、3.32g |
| B、4.16g |
| C、4.58g |
| D、4.41g |
对于混合物:碘的饱和水溶液、植物油和水、乙醇和水,你将采用何种方法按顺序把三种混合物分离开( )
| A、过滤、蒸馏、分液 |
| B、萃取、蒸馏、分液 |
| C、萃取、分液、蒸馏 |
| D、萃取、过滤、蒸馏 |
2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行研究并作出重大贡献的科学家.下列物质中属于生物大分子的是( )
| A、油脂 | B、葡萄糖 |
| C、蛋白质 | D、氨基酸 |
下列化学原理的应用,主要是利用沉淀溶解平衡原理来解释的是( )
①灰粪共用损肥分;
②使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙对牙齿起到更好的保护作用
③溶洞、珊瑚的形成;
④水垢中Mg(OH)2的形成;
⑤误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒.
①灰粪共用损肥分;
②使用含氟牙膏能生成更难溶且耐酸的氟磷酸钙对牙齿起到更好的保护作用
③溶洞、珊瑚的形成;
④水垢中Mg(OH)2的形成;
⑤误将钡盐[BaCl2、Ba(NO3)2]当做食盐食用后,常用0.5%的Na2SO4溶液解毒.
| A、①②③④ | B、②③⑤ |
| C、②③④⑤ | D、全部 |
25℃时,相同物质的量浓度下列溶液中,水的电离度由大到小排列顺序正确的是( )
①KNO3 ②NaOH ③NH4Ac ④NH4Cl.
①KNO3 ②NaOH ③NH4Ac ④NH4Cl.
| A、①>②>③>④ |
| B、④>③>①>② |
| C、③>④>②>① |
| D、③>④>①>② |
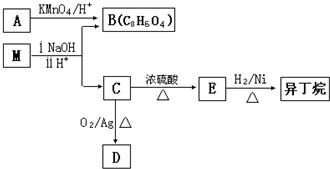
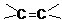 的方法是
的方法是 应先检验哪一个官能团?
应先检验哪一个官能团?