题目内容
8.按要求完成下列问题(1)写出下列反应的离子方程式:MnO2+4HCl═MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-═Mn2++Cl2↑+2H2O
(2)将离子方程式改写成化学方程式:2OH-+Mg2+═Mg(OH)2↓2NaOH+MgCl2═Mg(OH)2↓+2NaCl
(3)用双线桥表示电子转移情况 Fe2O3+3CO═2Fe+3C O2该反应的氧化产物是氧化产物是CO2

(4)用单线桥表示电子转移情况 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O该反应的氧化剂是HNO3
 .
.
分析 (1)氧化物形成化学式形式,氯化锰、HCl改写成离子形式;
(2)2OH-+Mg2+═Mg(OH)2↓可表示氢氧化钠与氯化镁反应;
(3)反应物所含元素化合价升高为还原剂,对应产物为氧化产物;反应中,Fe元素的化合价由+3降低为0,C元素的化合价由+2升高为+4价,据此解答;
(4)反应物所含元素化合价降低为氧化剂;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O中,N元素的化合价由+5价降低为+2价,还原剂发生氧化反应,该反应中转移6e-,以此来解答.
解答 解:(1)氧化物形成化学式形式,氯化锰、HCl改写成离子形式,反应离子方程式为:MnO2+4H+(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
答:反应离子方程式为:MnO2+4H+(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)2OH-+Mg2+═Mg(OH)2↓可表示氢氧化钠与氯化镁反应,化学方程式:2 NaOH+MgCl2═Mg(OH)2↓+2NaCl;
故答案为:2 NaOH+MgCl2═Mg(OH)2↓+2NaCl;
(3)Fe2O3+3CO═2Fe+3C O2该反应中一氧化碳中的C化合价升高,所以CO为还原剂,对应产物CO2为氧化产物,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O中,Cu元素的化合价由0升高为+2价,即Cu元素的化合价升高,被氧化,Cu为还原剂,发生氧化反应;
N元素的化合价由+5价降低为+4价,则HNO3为氧化剂;
该反应中转移6e-,所以单线桥表示反应的电子转移的方向和数目 ,
,
故答案为:HNO3; .
.
点评 本题考查离子方程式书写、氧化还原反应,明确离子反应实质,元素的化合价变化及氧化反应中的概念即可解答,注意单线桥标电子转移为解答的易错点,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 生理盐水指质量分数为0.9%的NaCl溶液 | |
| B. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-的离子数为0.2NA | |
| C. | 1L 1 mol/L K2CO3溶液中含有的钾离子数目为NA | |
| D. | 0.1 mol/L BaCl2溶液中,Cl-的物质的量浓度为0.1 mol/L |
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E 溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1mol A的溶液与含1m ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol-1
H2O(g)═H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)?CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
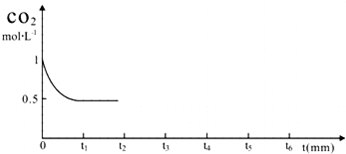
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据如表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).