题目内容
将40gNaOH溶于水,配成250mL溶液A:
(1)溶液A的物质的量浓度为多少?
(2)将50mLA加水稀释至100mL后,得溶液B,B的物质的量浓度为多少?
(1)溶液A的物质的量浓度为多少?
(2)将50mLA加水稀释至100mL后,得溶液B,B的物质的量浓度为多少?
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据n=
计算NaOH的物质的量,再根据c=
计算溶液物质的量浓度;
(2)稀释前后,溶质的物质的量保持不变,体积增大多少倍,浓度就减小多少倍.
| m |
| M |
| n |
| V |
(2)稀释前后,溶质的物质的量保持不变,体积增大多少倍,浓度就减小多少倍.
解答:
解:(1)NaOH的物质的量n=
=
=1mol,溶液物质的量浓度c=
=
=4mol/L,答:溶液A的物质的量浓度为4mol/L;
(2)50mLA中含有氢氧化钠的物质的量n=cV=4mol/L×0.05L=0.2mol,稀释前后,溶质的物质的量保持不变,B的物质的量浓度为c=
=
=2mol/L,答:B的物质的量浓度为2mol/L.
| m |
| M |
| 40g |
| 40g/mol |
| n |
| V |
| 1mol |
| 0.25L |
(2)50mLA中含有氢氧化钠的物质的量n=cV=4mol/L×0.05L=0.2mol,稀释前后,溶质的物质的量保持不变,B的物质的量浓度为c=
| n |
| V |
| 0.2mol |
| 0.1L |
点评:本题考查物质的量浓度有关计算,比较基础,关键是对物质的量浓度的理解.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列条件下,两瓶气体所含的原子数一定相等的是( )
| A、同体积、同密度的CO和CO2气体 |
| B、同温度、同体积的O2和O3气体 |
| C、同压强、同体积的N2O和CO2气体 |
| D、同质量、不同密度的O2和O3 气体 |
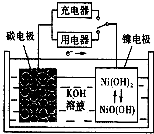 用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A、放电时,负极的电极反应为:H2-2e-+2OH-=2H2O |
| B、充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C、放电时,OH-移向镍电极 |
| D、充电时,将电池的碳电极与外电源的正极相连 |
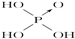
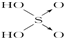
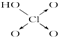
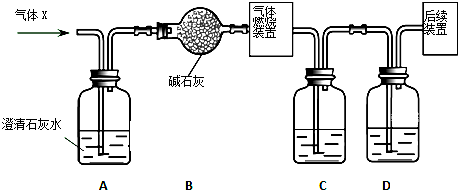
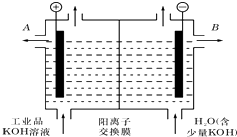 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: