题目内容
16.在反应3NO2+H2O=2HNO3+NO中,被氧化的NO2与未被氧化的NO2的质量比为( )| A. | 1:2 | B. | 3:1 | C. | 1:3 | D. | 2:1 |
分析 NO2与水反应方程式3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,据此判断.
解答 解:NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,
所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,
由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,
所以被氧化的NO2与被还原的NO2的物质的量之比为2:1,即被氧化的NO2与未被氧化的NO2的质量比为2:1.
故选D.
点评 本题考查氧化还原反应计算、氧化还原反应概念,难度中等,理解基本概念,关键根据产物中化合价判断起氧化剂与还原剂的NO2物质的量之比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.金属钠、钾燃烧引起失火时,最适宜灭火的是( )
| A. | 泡沫灭火器 | B. | 液态CO2灭火器 | C. | 大量水降温 | D. | 干细砂 |
7.下列化学变化中,相关示意图错误的是( )
| A. | 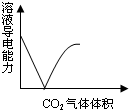 CO2通入澄清石灰水 | B. | 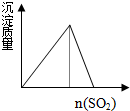 水玻璃中通入SO2 | ||
| C. | 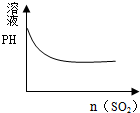 氯水中通入SO2 | D. | 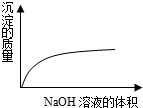 NaOH溶液滴入Ba(HCO3)2溶液 |
11.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定含NH4+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 将某气体通入品红溶液中,红色褪去,该气体一定是SO2 | |
| D. | 向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中一定含有SO42- |
1.苯与乙烯相比较,下列叙述正确的是( )
| A. | 都可以与溴发生取代反应 | |
| B. | 乙烯易发生加成反应,苯不能发生加成反应 | |
| C. | 常温下都是气态物质 | |
| D. | 乙烯易被酸性高锰酸钾溶液氧化,而苯不能 |
5.制造太阳能电池需要高纯度的硅,工业上由粗硅制高纯度硅通常通过以下反应实现:①Si+3HCl$\stackrel{300℃}{→}$SiHCl3+H2+Q (Q>0)②SiHCl3+H2$\stackrel{950℃}{→}$ Si+3HCl-Q(Q>0).关于上述条件下的两个反应的叙述中不正确的是( )
| A. | 两个反应都是置换反应 | B. | 反应①是放热反应 | ||
| C. | 上述两个反应是可逆反应 | D. | 两个反应都是氧化还原反应 |
6.在硫酸的工业制法中,下列生产操作及主要原因都正确的是( )
| A. | 硫铁矿煅烧前需适当粉碎,目的是增大反应物转化率 | |
| B. | 沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 | |
| C. | 接触室中使用热交换器,主要目的是提高SO2的转化率 | |
| D. | 吸收塔中用98.3%硫酸吸收SO3,目的是防止形成酸雾,SO3使吸收完全 |
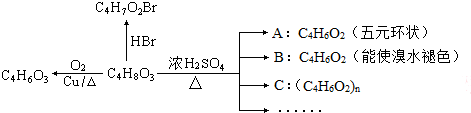
 +H2O;
+H2O; .合成路线示例如下:
.合成路线示例如下:
