题目内容
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 、 ,①和⑥中都用到的仪器为 ;
(2)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 .
(a)玻璃棒(b) 烧杯(c) 烧瓶 (d)容量瓶
(3)x与溶液B反应的离子方程式为 ;
(4)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致.
现给出以下试剂:1.0mol?L-1硫酸、1.0mol?L-1 NaOH溶液、0.1mol?L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证该同学的猜测是否合理.简要说明实验步骤和现象 ;
(5)某同学用实验制得的Fe2(SO4)3 晶体配制0.1mol?L-1 的Fe2(SO4)3 溶液,在称量出Fe2(SO4)3 晶体后,溶解该晶体的具体操作为 .

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为
(2)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
(a)玻璃棒(b) 烧杯(c) 烧瓶 (d)容量瓶
(3)x与溶液B反应的离子方程式为
(4)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致.
现给出以下试剂:1.0mol?L-1硫酸、1.0mol?L-1 NaOH溶液、0.1mol?L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证该同学的猜测是否合理.简要说明实验步骤和现象
(5)某同学用实验制得的Fe2(SO4)3 晶体配制0.1mol?L-1 的Fe2(SO4)3 溶液,在称量出Fe2(SO4)3 晶体后,溶解该晶体的具体操作为
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:废弃固体(主要成分Cu2S和Fe2O3)灼烧,发生的反应为,Cu2S+2O2
SO2+2CuO,得到的气体a为SO2,固体A为CuO和Fe2O3,向固体A中加入稀硫酸,发生反应CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,得到的溶液A中溶质为硫酸铜、硫酸铁、硫酸,向A中加入过量Fe,发生的反应为Fe+H2SO4=FeSO4+H2↑、CuSO4+Fe=FeSO4+Cu、Fe2(SO4)3+Fe=3FeSO4,将溶液过滤得到的固体B成分为Cu、Fe,滤液B中成分为FeSO4,将固体B溶于稀硫酸,然后过滤洗涤得到固体Cu;
向滤液B中加入试剂x,得到溶液C,将溶液C蒸发浓缩、冷却结晶得到Fe2(SO4)3晶体,x应该具有强氧化性,能将亚铁离子氧化为铁离子且不能引进新的杂质,所以x为H2O2,再结合题目分析解答.
| ||
向滤液B中加入试剂x,得到溶液C,将溶液C蒸发浓缩、冷却结晶得到Fe2(SO4)3晶体,x应该具有强氧化性,能将亚铁离子氧化为铁离子且不能引进新的杂质,所以x为H2O2,再结合题目分析解答.
解答:
解:废弃固体(主要成分Cu2S和Fe2O3)灼烧,发生的反应为,Cu2S+2O2
SO2+2CuO,得到的气体a为SO2,固体A为CuO和Fe2O3,向固体A中加入稀硫酸,发生反应CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,得到的溶液A中溶质为硫酸铜、硫酸铁、硫酸,向A中加入过量Fe,发生的反应为 Fe+H2SO4=FeSO4+H2↑、CuSO4+Fe=FeSO4+Cu、Fe2(SO4)3+Fe=3FeSO4,将溶液过滤得到的固体B成分为Cu、Fe,滤液B中成分为FeSO4,将固体B溶于稀硫酸,然后过滤洗涤得到固体Cu;
向滤液B中加入试剂x,得到溶液C,将溶液C蒸发浓缩、冷却结晶得到Fe2(SO4)3晶体,x应该具有强氧化性,能将亚铁离子氧化为铁离子且不能引进新的杂质,所以x为H2O2,
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为坩埚、坩埚钳,①为灼烧、⑥为蒸发浓缩、冷却结晶,①和⑥中都用到的仪器为玻璃棒,
故答案为:坩埚;坩埚钳;玻璃棒;
(2)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有容量瓶、胶头滴管、烧杯、玻璃棒,故选(a)(b)(d);
(3)x是双氧水、B是硫酸亚铁,二者反应生成硫酸铁、水,所以X与溶液B反应的离子方程式为2Fe2++H2O2 +2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,
故答案为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol?L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理);
(5)Fe2(SO4)3 是强酸弱碱盐,铁离子易水解生成氢氧化铁,为防止铜离子水解,所以配制0.1mol?L-1 的Fe2(SO4)3 溶液时,在称量出Fe2(SO4)3 晶体后,溶解该晶体的具体操作为:将硫酸铁晶体溶于稀硫酸中然后加水稀释,故答案为:将硫酸铁晶体溶于稀硫酸中然后加水稀释.
| ||
向滤液B中加入试剂x,得到溶液C,将溶液C蒸发浓缩、冷却结晶得到Fe2(SO4)3晶体,x应该具有强氧化性,能将亚铁离子氧化为铁离子且不能引进新的杂质,所以x为H2O2,
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为坩埚、坩埚钳,①为灼烧、⑥为蒸发浓缩、冷却结晶,①和⑥中都用到的仪器为玻璃棒,
故答案为:坩埚;坩埚钳;玻璃棒;
(2)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有容量瓶、胶头滴管、烧杯、玻璃棒,故选(a)(b)(d);
(3)x是双氧水、B是硫酸亚铁,二者反应生成硫酸铁、水,所以X与溶液B反应的离子方程式为2Fe2++H2O2 +2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,
故答案为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol?L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理);
(5)Fe2(SO4)3 是强酸弱碱盐,铁离子易水解生成氢氧化铁,为防止铜离子水解,所以配制0.1mol?L-1 的Fe2(SO4)3 溶液时,在称量出Fe2(SO4)3 晶体后,溶解该晶体的具体操作为:将硫酸铁晶体溶于稀硫酸中然后加水稀释,故答案为:将硫酸铁晶体溶于稀硫酸中然后加水稀释.
点评:本题考查混合物的分离和提纯,侧重考查基本实验操作、实验方案设计、离子检验、氧化还原反应等知识点,为高考常见题型,明确物质性质是解本题关键,知道每一步发生的反应及其物质分离方法,难点是(4)实验方案设计,题目难度中等.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
下列说法不正确的是( )
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D、向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 |
表示0.1mol/L NaHCO3溶液中有关粒子浓度的关系正确的是 ( )
| A、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g)+2B(g)?C(g) 反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A、前10 min内反应的平均速率为v(C)=0.050 mol?L-1?min-1 |
| B、保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol |
| C、若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积,则A的转化率减小 |
| D、温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |




 生成A的反应类型是
生成A的反应类型是

 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2 的反应得到
的反应得到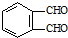 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式:
 化合物
化合物  是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2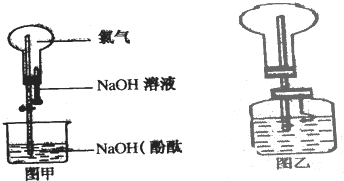 某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测:
某研究性学习小组在做Cl2的喷泉实验时(图甲),发现含有酚酞的NaOHaq喷入烧瓶后,溶液的红色褪去,甲、乙两同学对此现象分别做了如下推测: