题目内容
用以下装置制取无水氯化铜,请回答:
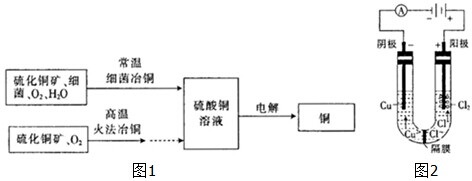
(1)将装置按3-5-4-2-1-6的顺序连接,装置④的作用是 ;
(2)装置⑥中发生反应的离子方程式是 ;
(3)实验开始时,应先检验装置的气密性,其方法是 ,实验结束时,应先熄灭 处的酒精灯.

(1)将装置按3-5-4-2-1-6的顺序连接,装置④的作用是
(2)装置⑥中发生反应的离子方程式是
(3)实验开始时,应先检验装置的气密性,其方法是
考点:制备实验方案的设计
专题:实验题
分析:将装置按3-5-4-2-1-6的顺序连接,3-5组成制气装置,4-2为净化装置,先用饱和氯化钠溶液除去氯化氢气体,再用浓硫酸除水,1为氯气和铜反应的装置,6为尾气吸收装置;
(1)实验室制取氯气的除杂;
(2)根据氯气的化学性质进行尾气处理;
(3)微热法检验装置的气密性,根据防止倒吸解答..
(1)实验室制取氯气的除杂;
(2)根据氯气的化学性质进行尾气处理;
(3)微热法检验装置的气密性,根据防止倒吸解答..
解答:
解:该实验为:制取无水氯化铜,先要制得纯净的氯气,氯气有毒,要对反应后的尾气进行处理,将装置按3-5-4-2-1-6的顺序连接,3-5组成制气装置,4-2为净化装置,先用饱和氯化钠溶液除去氯化氢气体,再用浓硫酸除水,1为氯气和铜反应的装置,6为尾气吸收装置;
(1)将装置按3-5-4-2-1-6的顺序连接,由上述分析知,装置④中应该盛放饱和食盐水,降低氯气在水中的溶解度,HCl溶于水,被除去,故装置④的作用是:除去氯气中的氯化氢气体;
故答案为:除去氯气中的氯化氢气体;
(2)在氯气与铜反应后,会有一部分氯气没有参与反应,直接排放带空气中会造成环境污染,装置⑥为用氢氧化钠除掉氯气的装置,氯气和氢氧化钠反应,生成氯化钠、次氯酸钠和水,离子式为:Cl2-+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2-+2OH-=Cl-+ClO-+H2O;
(3)将装置按3-5-4-2-1-6的顺序连接好后,6中盛水,将分液漏斗活塞关闭,把导管末端的放入水中,加热烧瓶,若有气泡冒出,停止加热,有一段水柱上升,一段时间后,液面不变,证明装置气密性良好;为防止倒吸应先熄灭(1)处的酒精灯,待冷却后再熄灭(5)处的酒精灯;
故答案为:连接好后,6中盛水,将分液漏斗活塞关闭,把导管末端的放入水中,加热烧瓶,若有气泡冒出,停止加热,有一段水柱上升,一段时间后,液面不变,证明装置气密性良好;(1).
(1)将装置按3-5-4-2-1-6的顺序连接,由上述分析知,装置④中应该盛放饱和食盐水,降低氯气在水中的溶解度,HCl溶于水,被除去,故装置④的作用是:除去氯气中的氯化氢气体;
故答案为:除去氯气中的氯化氢气体;
(2)在氯气与铜反应后,会有一部分氯气没有参与反应,直接排放带空气中会造成环境污染,装置⑥为用氢氧化钠除掉氯气的装置,氯气和氢氧化钠反应,生成氯化钠、次氯酸钠和水,离子式为:Cl2-+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2-+2OH-=Cl-+ClO-+H2O;
(3)将装置按3-5-4-2-1-6的顺序连接好后,6中盛水,将分液漏斗活塞关闭,把导管末端的放入水中,加热烧瓶,若有气泡冒出,停止加热,有一段水柱上升,一段时间后,液面不变,证明装置气密性良好;为防止倒吸应先熄灭(1)处的酒精灯,待冷却后再熄灭(5)处的酒精灯;
故答案为:连接好后,6中盛水,将分液漏斗活塞关闭,把导管末端的放入水中,加热烧瓶,若有气泡冒出,停止加热,有一段水柱上升,一段时间后,液面不变,证明装置气密性良好;(1).
点评:本题把氯气的实验室制法和氯气的化学性质结合起来,考查学生对实验原理、实验装置的理解、仪器气密性的检查等,难度中等,注意实验室制取氯气结束后,先使反应停止并排出残留的氯气,再拆卸装置,避免污染空气.

练习册系列答案
相关题目
下列试剂不能长期贮存在玻璃瓶中的是( )
| A、浓盐酸 | B、浓硫酸 |
| C、浓氢氧化钠溶液 | D、浓食盐水 |
甲烷的燃热为890kJ/mol,下列热化学方程式正确的是( )
| A、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ/mol |
| B、CH4+2O2═CO2+2H2O△H=-890kJ/mol |
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol |
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890kJ/mol |
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
| A、⑤ | B、只有① | C、②④ | D、①③ |
液氨与水相似,存在着微弱的电离:2NH3?NH4++NH2-.-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是( )
| A、此温度下,液氨的离子积等于1×10-30 |
| B、在液氨中放人NaNH2,则液氨的离子积数值将增大 |
| C、此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L |
| D、在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-) |
中和0.5mol H+,需要Ba(OH)2的物质的量为( )
| A、0.5mol |
| B、0.25mol |
| C、1mol |
| D、1.5mol |