题目内容
3.A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有B盐溶液呈蓝色.②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.(1)根据上述实验事实,推断这四种盐的化学式分别为:
AAgNO3;BCuSO4;CNa2CO3;DBaCl2.
(2)写出下列反应的离子方程式:
①A+D→:Ag++Cl-=AgCl↓,
②B+D→:CO32-+Ba2+=BaCO3↓,
③C+HCl→气体:CO32-+2H+=CO2↑+H2O.
分析 B盐的溶液呈蓝色,说明B盐中含有Cu2+,分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,说明A盐中含有Ag+;C盐溶液中有较多气泡产生,说明C盐中含有CO32-;又A、B、C、D四种盐均为可溶性盐,故A盐为AgNO3;C盐为Na2CO3,B盐为CuSO4;D盐为BaCl2,以此解答该题.
解答 解:(1)B盐的溶液呈蓝色,说明B盐中含有Cu2+,分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,说明A盐中含有Ag+;C盐溶液中有较多气泡产生,说明C盐中含有CO32-;又A、B、C、D四种盐均为可溶性盐,故A盐为AgNO3;C盐为Na2CO3,B盐为CuSO4;D盐为BaCl2,以此解答该题.
故答案为:AgNO3;CuSO4;Na2CO3;BaCl2;
(2)A盐为AgNO3;C盐为Na2CO3,B盐为CuSO4;D盐为BaCl2,
①A、D之间的反应为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
②B、D之间的反应为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
③C和HCl生成气体的反应为:CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O.
点评 本题是对离子组合的考查.对于这类题目,必须掌握好相互离子之间的反应.同时,对于一些有色离子,需加强记忆.中学阶段常见的有色离子有:
①Cu2+:蓝色;②Fe2+:浅绿色;③Fe3+:棕黄色;④MnO4ˉ:紫红色;
另外,在解题过程中,需注意审清题意,如此题中“A、B、C、D四种可溶性盐”,若没有这个条件,则有多种不同的结论.因此,审清题意很关键.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |
8.在酸性溶液中,下列物质氧化KI时,自身发生如下变化:IO3-→I2;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO.如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A. | IO3- | B. | MnO4- | C. | Cl2 | D. | HNO3 |
12.已知某药物具有抗痉挛作用,制备该药物其中一步反应为:
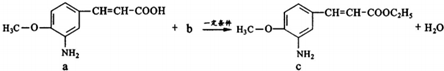
下列说法不正确的是( )
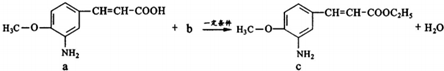
下列说法不正确的是( )
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
13.已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时硝酸的还原产物可能是( )
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |