题目内容
8.在酸性溶液中,下列物质氧化KI时,自身发生如下变化:IO3-→I2;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO.如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )| A. | IO3- | B. | MnO4- | C. | Cl2 | D. | HNO3 |
分析 等物质的量的氧化剂得到电子越多,生成碘越大,且IO3-的还原产物也为碘,以此来解答.
解答 解:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1molIO3-→I2得5mole-,
B、1molMnO4-→Mn2+得5mole-,
C、1molCl2→2Cl-得2mole-,
D、1molHNO3→NO得1mole-;
且IO3-的还原产物也为碘,则A中生成的I2就最多,
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应转移电子的计算,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
19.下列有关叙述正确的是( )
| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
13.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )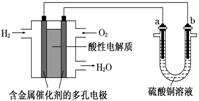

| A. | a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
20.在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含离子种类由多到少的顺序是( )
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
17.根据有机化合物的命名原则,下列命名错误的是( )
| A. | 2,3-二甲基-4-乙基己烷 | B. |  1,2-二甲苯 1,2-二甲苯 | ||
| C. |  甲酸苯酚酯 甲酸苯酚酯 | D. |  苯甲酸甲酯 苯甲酸甲酯 |