题目内容
13.密闭容器中装有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体是Na2CO3、NaOH;物质的量分别为1mol、0.6mol.分析 首先是NaHCO3的分解反应:1 NaHCO3=0.5 Na2CO3+0.5H2O+0.5CO2↑,生成的H2O和CO2都可以与Na2O2反应,但是应该是CO2优先于H2O反应.即使H2O先与Na2O2反应生成NaOH,也会与CO2生成Na2CO3,这两个反应等价于CO2与Na2O2的反应,依据生成的二氧化碳和水分别于过氧化钠反应的定量关系计算得到剩余产物和物质的量.
解答 解:按照题干所给数据书写对应反应的方程式,密闭容器中装有1mol NaHCO3和0.8mol Na2O2,加热充分反应,首先是NaHCO3的分解反应:1 NaHCO3=0.5 Na2CO3+0.5H2O+0.5CO2↑,生成的H2O和CO2都可以与Na2O2反应,但是应该是CO2优先于H2O反应.即使H2O先与Na2O2反应生成NaOH,也会与CO2生成Na2CO3,这两个反应等价于CO2与Na2O2的反应,因此二氧化碳先,水后反应的顺序进行计算,
0.5CO2+0.5Na2O2=0.5Na2CO3 +0.25O2↑,
0.3H2O+0.3 Na2O2=0.6NaOH+0.15O2↑,
最后固体是 1molNa2CO3和0.6molNaOH
故答案为:Na2CO3、NaOH;1mol、0.6mol
点评 本题考查了过氧化钠、碳酸氢钠性质,主要是二氧化碳和水蒸气于过氧化钠反应的定量关系分析计算,注意化学方程式中定量关系的计算应用,题目难度中等.

练习册系列答案
相关题目
3.将两A、B分别用导线相连接,并同时插入电解质溶液中,发现A极的质量增加,则下列说法正确的是( )
| A. | 金属活动性:A>B | |
| B. | A极是正极,电解质溶液可以是盐酸 | |
| C. | B极是负极 | |
| D. | 要判断A极与B极是正极还是负极,还需考虑电解质溶液 |
1.下列说法正确的是( )
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
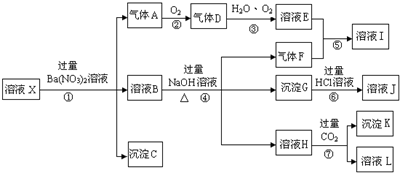
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色. 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: