题目内容
15.镁是一种重要的金属资源,在工业上用途广泛.回答下列问题:(1)已知某温度下Mg(OH)2的Ksp=6.4×l0-12,当溶液中c(Mg2+)≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥8×10-4mol•L-1.
(2)已知常温下CH3COOH的电离常数为:Ka=l.75×10-5mol/L;NH3•H2O的电离常数为,Kb=1.76×l0-5mol/L.
A.NH4Cl溶液显酸性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示),NH4Cl溶液中所有离子的浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
B. CH3COONH4溶液显中 (填“酸”、“碱”或“中”)性.
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解.产生这种现象的原因存在以下两种观点.
观点①:2NH4++Mg(OH)2=2NH3•H2O+Mg2+;
观点②的离子方程式为NH4++H2O?NH3•H2O+H+Mg(OH)2+2H+=Mg2++2H2O.
要验证①和②谁是Mg(OH)2溶解的主要原因,可选取c(填序号)代替NH4Cl溶液作对照实验.
a. NH4NO3 b. (NH4)2SO4 c. CH3COONH4 d. NH4HSO4.
分析 (1)依据沉淀溶解平衡存在的溶度积常数计算得到;
(2)A.铵根离子水解显酸性;溶液中氯离子不水解,铵根离子水解浓度减小,溶液显酸性,氢离子浓度大于氢氧根离子浓度;
B.相同条件下,铵根离子与醋酸根离子的水解程度相同;
C.铵根离子水解生成氢离子,氢离子与氢氧化镁反应;CH3COONH4中含有铵根离子,溶液显中性.
解答 解:(1)Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol•L-1可视为沉淀完全,则Ksp=c(Mg2+)×c2(OH-)=6.4×10-12 ,c(OH-)≥8×10-4mol/L,
故答案为:8×10-4;
(2)A.铵根离子水解显酸性,其水解方程式为:NH4++H2O?NH3•H2O+H+;溶液中氯离子不水解,铵根离子水解浓度减小,溶液显酸性,氢离子浓度大于氢氧根离子浓度,则NH4Cl溶液中所有离子的浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
B.相同条件下,铵根离子与醋酸根离子的水解程度相同,所以CH3COONH4溶液显中性;
故答案为:中;
C.铵根离子水解生成氢离子,氢离子与氢氧化镁反应,其反应的离子方程式为:NH4++H2O?NH3•H2O+H+Mg(OH)2+2H+=Mg2++2H2O;CH3COONH4中含有铵根离子,溶液显中性,所以可以选用CH3COONH4与Mg(OH)2反应,若沉淀消失,说明观点①正确,否则观点②正确;
故答案为:NH4++H2O?NH3•H2O+H+Mg(OH)2+2H+=Mg2++2H2O;c.
点评 本题考查了溶度积常数的计算、盐的水解原理的应用和离子浓度大小比较、沉淀溶解平衡移动等,侧重于考查学生的分析能力和计算能力,题目难度中等.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案| A. | FeO | B. | Fe2O3 | C. | Al2O3 | D. | Fe3O4 |
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
| A. | 明矾作净水剂 | B. | 漂粉精作消毒剂 | ||
| C. | 甘油作护肤保湿剂 | D. | 铁粉作食品袋内的脱氧剂 |

| A. | 红曲素含有两种含氧官能团 | |
| B. | 红曲素分子式为C21H25O5 | |
| C. | 红曲素能使酸性高锰酸钾溶液褪色 | |
| D. | lmol红曲素最多能与2 mol NaOH反应 |
| A. | 具有腐蚀性的药品必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| B. | 使用容量瓶前,在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,即可使用 | |
| C. | 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇试管中并及时搅拌 | |
| D. | 油或酒精着火时都可以用水扑灭 |
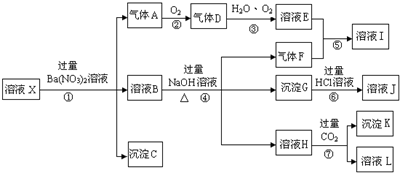
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.