题目内容
13.亚硝酸酰(Cl一N=O)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)=2ClNO(g).(l)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝既板,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H2 K3
△H3与△H3、△H2之间的关系式为△H3=2△H1-△H3;平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示).
(2)已知几种化学键的键能数据如表:
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与t的关系如图A所示.
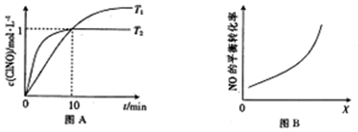
①反应开始到10min时,平均反应速率v(Cl2)=0.05mol/(L•min);
②T2时该反应的平衡常数K=2.
③NO的平衡转化率为50%.
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[压强、n(Cl2)/n(NO)、催化剂接触面],NO的平衡转化率变化如图B所示.X代表压强、$\frac{n(C{l}_{2})}{n(NO)}$.
分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H=反应物的键能之和-生成物的键能之和;
(3)①10min时c(ClNO)=1mol/L,根据v(ClNO)=$\frac{△c}{△t}$计算,再根据计量数的关系计算v(Cl2);
②根据化学平衡常数为平衡时生成物浓度幂之积与反应物浓度幂之积之比计算;
③NO的平衡转化率=$\frac{转化的物质的量}{起始的物质的量}$×100%;
(4)由图可知,随着外界条件的改变,NO的转化率增大,平衡向正方向移动,据此分析.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
将①×2-②可得:2NO(g)+Cl2(g)?2ClNO(g),该反应△H3=2△H1-△H2,则平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:2△H1-△H2;$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)2NO(g)+C12(g)?2C1NO(g)反应的△H3=反应物的键能之和-生成物的键能之和=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol,
则:△H3+2a=289kJ/mol
故答案为:289;
(3)①10min时c(ClNO)=1mol/L,则v(ClNO)=$\frac{△c}{△t}$=$\frac{1mol/L}{10min}$=0.1mol/(L•min),由方程式可知,v(Cl2)=$\frac{1}{2}$v(ClNO)=0.05mol/(L•min);
故答案为:0.05;
②平衡时c(ClNO)=1mol/L,c(NO)=1mol/L,c(Cl2)=0.5mol/L,则反应2NO(g)+Cl2(g)?2ClNO(g)的K=$\frac{{1}^{2}}{{1}^{2}×0.5}$=2;
故答案为:2;
③NO的平衡转化率=$\frac{转化的物质的量}{起始的物质的量}$×100%=$\frac{1mol}{2mol}$×100%=50%;
故答案为:50%;
(4)由图可知,随着外界条件的改变,NO的转化率增大,平衡向正方向移动,已知:2NO(g)+Cl2(g)?2ClNO(g),增大压强平衡向正方向移动,NO的转化率增大;增大$\frac{n(C{l}_{2})}{n(NO)}$的值,NO的转化率增大;增大催化剂接触面,化学平衡不移动,NO的转化率不变;
故答案为:压强;$\frac{n(C{l}_{2})}{n(NO)}$.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、盖斯定律的应用等知识点,侧重考查学生分析判断及计算能力,注意注意反应速率和平衡常数的计算方法、以及图象、数据的分析应用,题目难度中等.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. |  制NH3 | B. |  干燥NH3 | C. |  收集NH3 | D. |  吸收NH3 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 |
| B | 用黄铜片在铜片上刻画 | 铜片上有划痕 | 铜的硬度比黄铜小 |
| C | 用洁净的铁丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 溶液中一定含有Na+,可能含有K+ |
| D | 向硅酸钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比硅酸强 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  装置可用于除去NO气体中的NO2杂质 | |
| B. |  向图装置的溶液中滴入KSCN溶液不变红色,可以说明铁还没有发生吸氧腐蚀 | |
| C. |  装置用于灼烧碎海带以证明海带中存在I- | |
| D. |  图中的E1可表示有催化剂存在的条件下,对应反应的活化能 |
| A. | 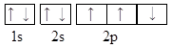 | B. | 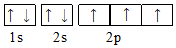 | ||
| C. | 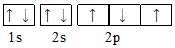 | D. |  |
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验 II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
(2)实验 III证明:氧化铁的化学性质和质量在反应前后均没有发生变化,可以作
过氧化氢分解的催化剂;
【实验评价】实验设计的目的是进行对比.
【实验拓展】
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.
下列有关催化剂的说法中正确的是BC.
A.二氧化锰只能作过氧化氢溶液分解的催化剂.
B.同一个化学反应可以有多种催化剂
C.催化剂的质量和性质在化学反应前后都不改变.
D.用作催化剂的物质不可能是其他反应的反应物或生成物.
 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
(2)仪器A的名称为分液漏斗.
(3)0~t时间段与t~2t时间段,化学反应速率快的是t~2t;原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解反应速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3/0.2mol/L CuCl2,完成下表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
②本实验需测定的数据是收集相同体积的氧气所需时间;
③A中装有10mL双氧水,未减少误差,加入其它物质的方法是连接分液漏斗前,直接加到锥形瓶中.
 )的合成路线:
)的合成路线:

 .A+D→E的反应类型为取代反应(酯化反应).
.A+D→E的反应类型为取代反应(酯化反应). .
.