题目内容
3.将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu═2FeCl2+CuCl2(1)请用双线桥法标出电子转移的方向和数目.
(2)当有0.3mol电子发生转移时,发生反应的Cu的质量为9.6g.
(3)请将以上反应改写为离子方程式2Fe3++Cu=2Fe2++Cu2+.
(4)配平下列方程式:2FeCl2+1H2O2+2HCl-2FeCl3+2H2O
(5)高锰酸钾和氢溴酸溶液可以发生下列反应:2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O,若消耗15.8g氧化剂KMnO4,则被氧化的还原剂的质量是40.5g.
分析 (1)反应2FeCl3+Cu═2FeCl2+CuCl2中,Fe元素化合价降低,被还原,FeCl3为氧化剂,Cu元素化合价升高,被氧化,Cu为还原剂;
(2)根据方程式和转移电子的量来计算;
(3)根据离子方程式的书写方法来回答,三种盐均为易溶于水的强电解质,要写成离子;
(4)铁元素化合价+2价升高为+3价,过氧化氢中氧元素化合价-1价变化为-2价,电子转移总数2e-,结合原子守恒和原子守恒配平书写;
(5)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算.
解答 解:(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,双线桥法表示电子转移的方向和数目如下: ,
,
故答案为: ;
;
(2)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,
故答案为:9.6g;
(3)反应2FeCl3+Cu=2FeCl2+CuCl2改为离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)铁元素化合价+2价升高为+3价,过氧化氢中氧元素化合价-1价变化为-2价,电子转移总数2e-,结合原子守恒和原子守恒配平书写得到化学方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2、1、2、2、2;
(5)Br元素化合价升高,Mn元素化合价降低,反应中KMnO4为氧化剂,MnBr2为还原产物,HBr为还原剂,Br2为氧化产物;Br元素化合价升高1价,Mn元素化合价降低5价,反应中转移10个电子,则用双线桥标出该反应的电子转移方向和数目为 ;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;
;被氧化的HBr占总的参加反应的HBr的$\frac{5}{8}$,则被氧化的还原剂的质量是$\frac{5}{8}$×64.8g=40.5g;
故答案为:40.5.
点评 本题综合考查氧化还原反应的概念和计算、以及离子方程式的书写,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度分析氧化还原反应的相关概念和物质的性质,题目难度中等.

 阅读快车系列答案
阅读快车系列答案(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ•mol-1,△S=+133.7J•mol-1•K-1,
①该反应在低温下不能(填“能”或“不能”)自发进行.
②写出该反应的平衡常数表达式k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5.
①在400℃时,2NH3(g)?N2(g)+3H2(g)的K′=2(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正= v(N2)逆(填“>”、“<”、“=”或“不能确定”).
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡向左移动(填“向左”、“向左”或“不”);使用催化剂,反应的△H不改变(填“增大”、“减小”或“不改变”).
(3)水煤气转化反应CO(g)+H2O(g)?CO2(g)+H2(g)在一定温度下达到化学平衡.现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组教据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②实验1的平衡常数K1大于实验2的平衡常数K2 (填“大于””小于,“等于”“不能确定”).
③该反应正方向为放 (填“吸”或‘放”)热反应.
 △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 | |
| B. | 顺-2-丁烯比反-2-丁烯更稳定 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰 |
| A. | SiO2和CO2常温都是气体分子 | |
| B. | CO2、SiO2均能和氢氟酸反应 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
| A. | ①②③ | B. | ①⑤ | C. | ①②③⑤ | D. | ③④⑤ |
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
(l)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝既板,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H2 K3
△H3与△H3、△H2之间的关系式为△H3=2△H1-△H3;平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示).
(2)已知几种化学键的键能数据如表:
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与t的关系如图A所示.
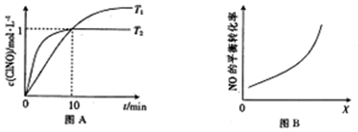
①反应开始到10min时,平均反应速率v(Cl2)=0.05mol/(L•min);
②T2时该反应的平衡常数K=2.
③NO的平衡转化率为50%.
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[压强、n(Cl2)/n(NO)、催化剂接触面],NO的平衡转化率变化如图B所示.X代表压强、$\frac{n(C{l}_{2})}{n(NO)}$.

 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )