题目内容
10.下列措施或事实不能用勒夏特列原理解释的是( )| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
分析 平衡移动列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用平衡移动原理时,该反应必须是可逆反应,否则不适用平衡移动原理.
解答 解:A.氯水中存在平衡Cl2+H2O?HClO+H++Cl-,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,故A不选;
B.Fe(SCN)3溶液中存在Fe(SCN)3?Fe3++3SCN-,加入固体KSCN,SCN-浓度增大,平衡逆向移动,颜色加深,能用勒夏特列原理解释,故B不选;
C.合成氨反应为N2+3H2?2NH3,△H<0,降温或加压平衡向正方向移动,可用勒夏特列原理解释,故C不选;
D.可逆反应为H2(g)+I2(g)?2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,颜色加深是体积改变的原因,不能用用勒夏特列原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,明确平衡移动原理适用范围是解本题关键,只有改变条件能影响平衡移动的可逆反应才能用平衡移动原理解释,易错选项是D.

练习册系列答案
相关题目
20.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:①>③>② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
18.等质量的钠、镁、铝分别与足量的盐酸反应,产生H2的质量由大到小的排列顺序正确的是( )
| A. | Al、Mg、Na | B. | Mg、Al、Na | C. | Na、Mg、Al | D. | Na、Al、Mg |
5.下列离子方程式的书写正确的是( )
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
15.下列叙述正确的是( )
| A. | 尽管NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 | |
| B. | Na2O 溶于水所得溶液能导电,据此可判断 Na2O属于电解质 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 某气体只含N、H 两种元素,且质量之比为14:3,则该气体一定为纯净物 |
2.S-诱抗素制剂的分子结构如图,下列关于该分子说法正确的是( )
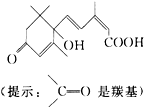

| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 含有苯环、羟基、羰基、羧基 | ||
| C. | 含有羟基、羰基、羧基、酯基 | D. | 含有碳碳双键、苯环、羟基、羰基 |
19.一定温度和压强下,下列各可逆反应达到化学平衡状态,各反应有如图所示的对应关系:

(1)N2(g)+3H2(g)?2NH3(g)△H<0(曲线Ⅰ)
(2)H2(g)+I2(g)?2HI(g)△H>0(曲线Ⅱ)
(3)2SO3(g)?2SO2(g)+O2(g)△H>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是( )

(1)N2(g)+3H2(g)?2NH3(g)△H<0(曲线Ⅰ)
(2)H2(g)+I2(g)?2HI(g)△H>0(曲线Ⅱ)
(3)2SO3(g)?2SO2(g)+O2(g)△H>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是( )
| A. | 平衡混合气的平均相对分子质量 | |
| B. | 平衡混合气中一种反应物的浓度 | |
| C. | 平衡混合气中一种生成物的体积分数 | |
| D. | 平衡混合气中一种反应物的体积分数 |