题目内容
17.在10L的容器中,充入CO和H2O各2mol,在800℃发生化学反应,达到化学平衡时有50%的CO转化为CO2,计算各物质的平衡浓度和平衡常数.若使CO转化率提高到80%,还需要补充多少摩尔水气?分析 800℃时,在10L的容器中充入CO和H2O各2mol,达到化学平衡时有50%的CO转化为CO2,转化的CO2为1mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol):2 2 0 0
变化(mol):1 1 1 1
平衡(mol):1 1 1 1
根据c=$\frac{n}{V}$计算各物质平衡浓度,根据K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
设需要加入xmol水才能使CO平衡转化率达到80%,则转化的CO为1.6mol,表示出平衡时各组分的物质的量,再根据平衡常数列方程计算.
解答 解:800℃时,在10L的容器中充入CO和H2O各2mol,达到化学平衡时有50%的CO转化为CO2,转化的CO2为1mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol):2 2 0 0
变化(mol):1 1 1 1
平衡(mol):1 1 1 1
平衡时c(CO)=c(H2O)c(CO2)=c(H2)=$\frac{1mol}{10L}$=0.1mol/L,
平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.1×0.1}{0.1×0.1}$=1,
设需要加入xmol水才能使CO平衡转化率达到80%,则转化的CO为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol):2 2+x 0 0
变化(mol):1.6 1.6 1.6 1.6
平衡(mol):0.4 0.4+x 1.6 1.6
故$\frac{1.6×1.6}{0.4×(0.4+x)}$=1,解得x=6
答:平衡时各物质的平衡浓度均为0.1mol/L,平衡常数为1,若使CO转化率提高到80%,还需要补充6摩尔水气.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

 阅读快车系列答案
阅读快车系列答案| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
| A. | 化学反应 | B. | 水的电离 | C. | 盐的水解 | D. | 干冰的升华 |
①常温下S为固体,而Cl2为气体
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度
③与Fe反应,Cl2生成FeCl3,而S生成FeS
④盐酸是强酸,而氢硫酸是弱酸
⑤将Cl2通入氢硫酸中可置换出S.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
探究一:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl- 2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是排除空气中二氧化碳对实验的干扰;
(2)反应结束后,缓缓通入空气的目的是使生成的气体全部进入装置⑤;
(3)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
探究二:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(5)下列选项错误的是AD
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
(6)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为KHCO3.
(7)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、
“<”或“=”)
| A. | 钠是一种灰黑色、具有金属光泽、质地软的金属 | |
| B. | 氧化钠与过氧化钠的颜色不同 | |
| C. | 因为钠的性质非常活泼,故自然界中无游离态钠 | |
| D. | 过氧化钠可以做潜艇的供氧剂 |

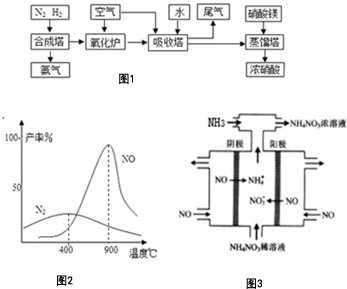 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题