题目内容
5.下列离子方程式的书写正确的是( )| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
分析 A.反应生成氯化亚铁和水;
B.反应生成硫酸钠、氢氧化铜、氢气;
C.反应生成的HClO在离子反应中保留化学式;
D.反应生成硅酸钠和水.
解答 解:A.氧化亚铁与稀盐酸反应的离子反应为FeO+2H+═Fe2++H2O,故A错误;
B.将Na投入到CuSO4溶液的离子反应为2H2O+2Na+Cu2+═2Na++Cu(OH)2↓+H2↑,故B错误;
C.氯气与水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故C错误;
D.SiO2与NaOH溶液反应的离子反应为SiO2+2OH-═SiO32-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
15.下列叙述或表示正确的是( )
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
20.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2+9H2O,在反应中还原产物与氧化产物的质量之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
10.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
17.下列说法正确的是( )
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
14.(1)今有下列三组物质,每组中都有一种物质跟其他三种属于不同的种类.将此种物质(写化学式)和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内.三组物质分别为:
(1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、CaO.
(2)已知钠是一种活泼的金属单质,可与冷水发生如下反应:2Na+2H2O═2NaOH+H2↑.则此反应是否是置换反应?是(填“是”或“否”),将其反应式改写为离子方程式:2Na+2H2O=2Na++2OH-+H2↑.氢氧化铝也是一种两性氢氧化物,其中一个反应为:Al(OH)3+NaOH═NaAlO2+2H2O,将其反应式改写为离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(1)O2、F2、S、N2;
(2)Fe、Na、Al、Si;
(3)NO、CO2、SO2、CaO.
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | ||
| 第(2)组 | ||
| 第(3)组 |
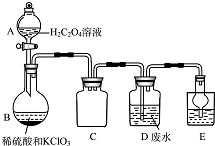 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题: