题目内容
部分弱酸的电离平衡常数如表:
(1)请写出HNO2的电离方程式
(2)上表的5种酸进行比较,酸性最弱的是: ;
(3)在浓度均为0.1mol/L 的 HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是: .
(4)已知HNO2具有强氧化性,弱还原性.将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式: .
(5)下列离子方程式书写正确的是
A.HNO2+HS-═NO2-+H2S↑
B.2HCOOH+SO32-═2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-═2HCOOH+SO32-
D.H2SO3+SO32-═2HSO3-.
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
(2)上表的5种酸进行比较,酸性最弱的是:
(3)在浓度均为0.1mol/L
(4)已知HNO2具有强氧化性,弱还原性.将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:
(5)下列离子方程式书写正确的是
A.HNO2+HS-═NO2-+H2S↑
B.2HCOOH+SO32-═2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-═2HCOOH+SO32-
D.H2SO3+SO32-═2HSO3-.
考点:弱电解质在水溶液中的电离平衡,离子方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)亚硝酸溶液中存在电离平衡,所以亚硝酸是弱酸,亚硝酸电离生成氢离子和亚硝酸根离子;
(2)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱;
(3)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数大小判断;
(4)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,据此书写方程式;
(5)强酸能和弱酸的盐反应生成弱酸和强酸盐.
(2)相同温度下,酸的电离平衡常数越小,其酸性越弱,弱酸的酸性越强,其酸根离子水解程度越小,则结合氢离子能力越弱;
(3)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数大小判断;
(4)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,据此书写方程式;
(5)强酸能和弱酸的盐反应生成弱酸和强酸盐.
解答:
解:(1)亚硝酸溶液中存在电离平衡,所以亚硝酸是弱酸,亚硝酸电离生成氢离子和亚硝酸根离子,所以电离方程式为HNO2?H++NO2-,故答案为:HNO2?H++NO2-;
(2)相同温度下,酸的电离平衡常数越小,其酸性越弱,根据电离平衡常数知,酸性最弱的是H2S,结合氢离子能力最弱的是HSO3-,故答案为:H2S;
(3)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数知,被OH-先后消耗的酸及酸式酸根依次是H2C2O4、HCOOH、HC2O4-,故答案为:H2C2O4、HCOOH、HC2O4-;
(4)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,该反应方程式为,故答案为:2HNO2+H2S=2H2O+2NO↑+S↓;
(5)A.亚硝酸具有强氧化性,硫氢根离子具有还原性,二者能发生氧化还原反应,所以离子方程式为H++2HNO2+HS-=2NO↑+S↓+2H2O,故A错误;
B.甲酸的酸性大于亚硫酸氢根离子小于亚硫酸,所以甲酸和亚硫酸根离子反应生成甲酸根离子和亚硫酸氢根离子,离子方程式为HCOOH+SO32-═HCOO-+HSO3-,故B错误;
C.甲酸的酸性大于亚硫酸氢根离子小于亚硫酸,所以亚硫酸和甲酸根离子反应生成甲酸和亚硫酸氢根离子,离子方程式为H2SO3+HCOO-═HCOOH+HSO3-,故C错误;
D.亚硫酸和亚硫酸根离子反应生成亚硫酸氢根离子,离子方程式为,故D正确;
故选D.
(2)相同温度下,酸的电离平衡常数越小,其酸性越弱,根据电离平衡常数知,酸性最弱的是H2S,结合氢离子能力最弱的是HSO3-,故答案为:H2S;
(3)酸的电离平衡常数越大,该酸的酸性越强,与碱反应越容易,根据酸的电离平衡常数知,被OH-先后消耗的酸及酸式酸根依次是H2C2O4、HCOOH、HC2O4-,故答案为:H2C2O4、HCOOH、HC2O4-;
(4)HNO2和H2S生成沉淀和无色气体,无色气体遇空气立即变为红棕色,则该无色气体是NO,亚硝酸具有强氧化性,硫化氢具有还原性,所以硫化氢被亚硝酸氧化生成S单质,根据元素守恒知还生成水,该反应方程式为,故答案为:2HNO2+H2S=2H2O+2NO↑+S↓;
(5)A.亚硝酸具有强氧化性,硫氢根离子具有还原性,二者能发生氧化还原反应,所以离子方程式为H++2HNO2+HS-=2NO↑+S↓+2H2O,故A错误;
B.甲酸的酸性大于亚硫酸氢根离子小于亚硫酸,所以甲酸和亚硫酸根离子反应生成甲酸根离子和亚硫酸氢根离子,离子方程式为HCOOH+SO32-═HCOO-+HSO3-,故B错误;
C.甲酸的酸性大于亚硫酸氢根离子小于亚硫酸,所以亚硫酸和甲酸根离子反应生成甲酸和亚硫酸氢根离子,离子方程式为H2SO3+HCOO-═HCOOH+HSO3-,故C错误;
D.亚硫酸和亚硫酸根离子反应生成亚硫酸氢根离子,离子方程式为,故D正确;
故选D.
点评:本题考查了弱电解质的电离,明确弱酸电离平衡常数与酸的酸性强弱、酸根离子水解程度的关系即可解答,注意(5)中A选项,很多同学只考虑强酸制取弱酸而忽略亚硝酸的强氧化性而导致错误,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、糖类、油脂、蛋白质在一定条件下都能发生水解反应 |
| D、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
下列说法正确的是( )
| A、凡能导电的物质一定是单质 |
| B、金属单质都能与稀硫酸发生置换反应 |
| C、活泼金属都能从盐溶液中置换出较不活泼的金属 |
| D、在化学反应中,金属单质失电子,常作还原剂 |
下列实验操作及结论都正确的是( )
| A、制取氢氧化铁胶体,可向沸水中加入FeCl3溶液 |
| B、加热蒸发NaHCO3溶液,最终可获得NaOH固体 |
| C、向醋酸溶液中加入固体的醋酸钠,可增大醋酸的电离度 |
| D、配制SnCl2溶液时,可加入过量的硫酸,抑制水解 |
氰酸HNCO(结构为H-N-C-O)可消除汽车尾气中的二氧化氮,发生反应的化学方程式为:8HNCO+6NO2=7N2+CO2+4H2O下列叙述中正确的是( )
| A、氮气是还原产物,二氧化碳是氧化产物 |
| B、HNCO中碳元素被氧化 |
| C、1molHNCO参加反应失去3mol电子 |
| D、氧化产物与还原产物质量比为1:1 |
下列各组离子在指定溶液中一定能大量共存的是( )
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、AlO2- |
| B、酸性溶液中可能大量存在Na+、MnO4-、SO42-、I- |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| D、0.1 mol?L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |

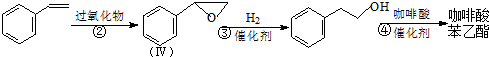
 的芳香化合物共有5种
的芳香化合物共有5种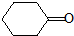 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为 甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示: