题目内容
12.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )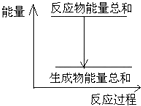
| A. | 反应过程中能量关系如图所示,则该反应为放热反应 | |
| B. | 化学反应的反应热与反应方程式的计量数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
分析 A、根据放热反应中反应物的总能量大于生成物的总能量;
B、根据反应热△H的值与反应方程式的计量系数成正比;
C、根据原电池的负极失去电子;
D、根据总反应方程式以及气体的体积与状态有关来计算.
解答 解:A、该反应为放热反应,反应物的总能量大于生成物的总能量,可用如图表示 ,故A正确;
,故A正确;
B、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,不一定为11.2L,故B错误;
C、反应热△H的值与反应方程式的计量系数成正比,故C正确;
D、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,不一定为11.2L,故D错误;
故选C.
点评 本题主要考查原电池原理、化学反应中的能量以及化学计算等,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
2.下列有关公众安全的叙述中,正确的是( )
| A. | 室内使用煤炉取暖时,为防止煤气中毒,应确保煤充分燃烧和烟道通畅 | |
| B. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域 | |
| C. | 家中发生天然气泄漏时,应立即使用室内电话报警 | |
| D. | 在房子中放一盆清水,可防止CO中毒 |
3.下列图示与对应的叙述相符的是( )
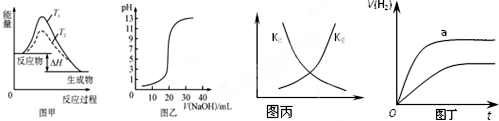

| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则aHCl表示溶液 |
20.如图所示,将纯Fe棒和石墨棒插入1L饱和NaCl溶液中.下列说法正确的是( )
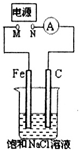

| A. | M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH | |
| B. | 去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红 | |
| C. | M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜 |
7.下列各组物质中,所含化学键类型完全相同的是( )
| A. | HCl和MgCl2 | B. | H2O和CO2 | C. | NH4Cl和CCl4 | D. | HCl和NaOH |
17.下列叙述正确的是( )
| A. | SO2具有强氧化性,故可作漂白剂 | |
| B. | 可通过加热氯化铵固体使其分解的办法来制备氨气 | |
| C. | 浓硝酸中的HNO3见光会分解,故要盛放在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价 |
10. 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
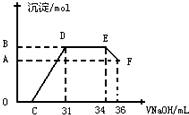
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
 2SO3.
2SO3.