题目内容
17.下列叙述正确的是( )| A. | SO2具有强氧化性,故可作漂白剂 | |
| B. | 可通过加热氯化铵固体使其分解的办法来制备氨气 | |
| C. | 浓硝酸中的HNO3见光会分解,故要盛放在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价 |
分析 A.二氧化硫能够与有机色素化合生成无色物质而具有漂白性;
B.氯化铵受热分解生成HCl和氨气,冷却时氨气与HCl结合生成氯化铵;
C.依据浓硝酸不稳定性解答;
D.铁和硫反应生成硫化亚铁.
解答 解:A.二氧化硫具有漂白性是因为二氧化硫能够与有机色素化合生成无色物质,故A错误;
B.在试管底部氯化铵受热分解生成HCl和氨气,在试管口氨气与HCl又重新结合生成氯化铵,所以得不到氨气,故B错误;
C.浓硝酸不稳定,浓HNO3见光会分解,故要盛放在棕色试剂瓶中,故C正确;
D.Fe在Cl2中燃烧生成FeCl3,与硫反应的产物中的Fe显+2价,故D错误;
故选:C.
点评 本题考查了二氧化硫、铵盐、浓硝酸、铁等物质性质的分析判断,注意二氧化硫漂白原理、常见试剂保存,题目难度不大.

练习册系列答案
相关题目
8.化学与生产、生活、社会密切关系,下列说法错误的是( )
| A. | 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同 | |
| B. | 燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放 | |
| C. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 | |
| D. | 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中 |
5.下列说法不正确的是( )
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 |
12.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( ) 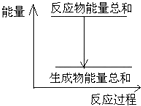

| A. | 反应过程中能量关系如图所示,则该反应为放热反应 | |
| B. | 化学反应的反应热与反应方程式的计量数有关 | |
| C. | 若将该反应设计成原电池,锌为负极 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
2.某单质跟浓硝酸反应时,每0.5mol单质反应就能将1mol硝酸还原为NO2,则单质被氧化后化合价为( )
| A. | +1价 | B. | +2价 | C. | +3价 | D. | +4价 |
6.有物质的量浓度均为0.1mol•L-1的①NH4Cl溶液,②NaCl溶液,③HCl溶液各20mL,下列说法错误的是( )
| A. | 三种溶液中c(Cl-)的关系是①=②=③ | |
| B. | 若将三种溶液稀释相同的倍数,pH变化最小的是② | |
| C. | 三种溶液中由水电离出的c(H+)的关系是①<②<③ | |
| D. | 若向三种溶液中分别加入20mL0.1mol•L-1的NaOH溶液后,pH最小的是③ |

 ;
;