题目内容
14.不同镜子背后的金属镀层可能是不同的,目前使用的金属主要有两种.为研究金属镀层的成分,某小组分别收集了两块镜子背面的金属镀层粉末甲和乙,按下述实验操作步骤进行实验:| 金属 | 实验操作 | 实验现象 |
| 甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 白色沉淀溶解 |
(1)甲与浓硝酸反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(2)实验操作⑤的实验现象是白色沉淀逐渐溶解至完全,乙溶解在NaOH溶液中反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)金属活动性:甲比乙弱.(填“强”、“弱”)
分析 ①取少量粉末,加入过量浓硝酸,粉末溶解,有红棕色气体产生,说明发生氧化还原反应生成二氧化氮气体;
②向上述溶液中加入几滴NaCl溶液,有白色沉淀生成,该沉淀为AgCl,则镀层金属为银;
③取少量粉末,加入足量NaOH溶液,④向上述溶液中逐滴加入稀盐酸,有白色沉淀生成,根据反应现象“粉末溶解,有气泡产生,有白色沉淀生成”可知,该镀层为Al,生成气泡为氢气,生成的沉淀为氢氧化铝;
⑤继续加入过量的稀盐酸,氢氧化铝沉淀溶解,据此进行解答.
解答 解:①取少量粉末,加入过量浓硝酸,粉末溶解,有红棕色气体产生,说明发生氧化还原反应生成二氧化氮气体;②向上述溶液中加入几滴NaCl溶液,有白色沉淀生成,该沉淀为AgCl,则镀层金属为银;③取少量粉末,加入足量NaOH溶液,④向上述溶液中逐滴加入稀盐酸,有白色沉淀生成,根据反应现象“粉末溶解,有气泡产生,有白色沉淀生成”可知,该镀层为Al,生成气泡为氢气,生成的沉淀为氢氧化铝;⑤继续加入过量的稀盐酸,氢氧化铝沉淀溶解,
故答案为:白色沉淀溶解;
(1)根据分析可知,甲中反应为银与浓硝酸的反应,反应方程式为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O,
故答案为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O;
(2)实验操作⑤中氢氧化铝与盐酸反应,沉淀会溶解,则实验现象为白色沉淀溶解;
乙中成分为Al,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:白色沉淀逐渐溶解至完全;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中金属为Ag,乙中金属为Al,比较铝和银的活泼性强弱,可将将打磨后的铝条插入硝酸银溶液中,铝能够置换出银,证明铝的活泼性大于Ag,甲比乙弱,
故答案为:弱.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的为解答关键,注意掌握性质实验方案设计与评价的原则,试题培养了学生的化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 蒸发过程中用玻璃棒不断搅拌 | |
| B. | 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中 | |
| C. | 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干 | |
| D. | 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上 |
| A. | CS2是极性键构成的极性分子 | |
| B. | SO2与CO2为等电子体 | |
| C. | 金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高 | |
| D. | 1molNaHSO4熔融态时有3mol离子 |
| A. | 原子核内质子数 | B. | 原子核中子数 | ||
| C. | 原子的最外层电子数 | D. | 原子的电子总数 |
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定不含K+ | |
| B. | 向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- | |
| C. | 向无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液中加入KSCN溶液无现象,再滴入少量H2O2,呈血红色,则该溶液中一定含有Fe2+ |
| A. | 氯气和水 | B. | 氯化氢和水 | ||
| C. | 二氧化碳和烧碱溶液 | D. | 氯气和烧碱溶液 |
| A. | 水的摩尔质量是18 g•mol-1 | B. | 硫离子的结构示意图: | ||
| C. | 8个质子、10个中子的原子:${\;}_{8}^{18}$O | D. | 四氯化硅中Si的化合价为-4 |
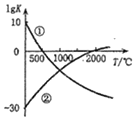 如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:①N2+3H2?2NH3;②N2+O2?2NO
根据图中的数据判断下列说法正确的是( )
| A. | 只有反应①是放热反应 | |
| B. | 升温,反应①的速率减小反应②的速率增大 | |
| C. | 可以在常温下利用反应①进行工业固氮 | |
| D. | 曲线的交点表示反应①和反应②体系中 N2 的转化率相等 |