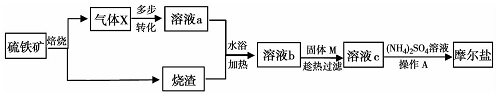
题目内容
5.粗盐的提纯实验中,下列操作错误的是( )| A. | 蒸发过程中用玻璃棒不断搅拌 | |
| B. | 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中 | |
| C. | 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干 | |
| D. | 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上 |
分析 A.蒸发时搅拌,防止局部温度过高,液滴飞溅;
B.热的蒸发皿倒入滤液,易导致液滴飞溅;
C.蒸发时利用余热加热;
D.蒸发后温度较高.
解答 解:A.蒸发时搅拌,防止局部温度过高,液滴飞溅,则用玻璃棒不断搅拌,故A正确;
B.热的蒸发皿倒入滤液,易导致液滴飞溅,则应先加滤液,后加热,故B错误;
C.蒸发时利用余热加热,则有较多固体析出时停止加热,故C正确;
D.蒸发后温度较高,则用坩埚钳把蒸发皿移至石棉网上,故D正确;
故选B.
点评 本题考查粗盐提纯实验,为高频考点,把握实验基本操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
16.下列各溶液中,有关成分的物质的量浓度关系正确的是( )
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+ )>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L pH为3的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| D. | c(NH4+ )相等的(NH4)2SO4溶液、(NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl) |
13.有4种碳架如下的烃,下列说法不正确的是( )

| A. | a和d是同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有a能使使酸性KMnO4溶液褪色 |
17.Cl和Cl-的相同之处是( )
| A. | 质子数 | B. | 核外电子数 | C. | 化学性质 | D. | 颜色 |
14.不同镜子背后的金属镀层可能是不同的,目前使用的金属主要有两种.为研究金属镀层的成分,某小组分别收集了两块镜子背面的金属镀层粉末甲和乙,按下述实验操作步骤进行实验:
根据实验,回答下列问题:
(1)甲与浓硝酸反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(2)实验操作⑤的实验现象是白色沉淀逐渐溶解至完全,乙溶解在NaOH溶液中反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)金属活动性:甲比乙弱.(填“强”、“弱”)
| 金属 | 实验操作 | 实验现象 |
| 甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 白色沉淀溶解 |
(1)甲与浓硝酸反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(2)实验操作⑤的实验现象是白色沉淀逐渐溶解至完全,乙溶解在NaOH溶液中反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)金属活动性:甲比乙弱.(填“强”、“弱”)