题目内容
19.零价铁(Fe)除去水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.(1)Fe还原水体中NO3-的反应原理如图所示.的反应原理如图1所示.
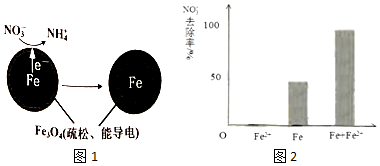
正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.pH=4.5(其他条件相同)
Ⅱ.高铁酸钠Na2FeO4
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式为.
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式.
分析 (1)Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;
(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;
(3)根据图2中的三个实验结果进行分析,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高;
(4)根据反应前后原子的种类与数目不发生改变进行判断;
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体,其中Fe元素化合价由+3价变为+6价,所以O元素化合价由-2价变为0价即有氧气生成,根据转移电子守恒、电荷守恒及原子守恒书写方程式.
解答 解:(1)Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,将铁全部覆盖阻碍电子转移,所以NO3-的去除率低.
故答案为:因为铁表面生成不导电的FeO(OH),将铁全部覆盖,阻止反应进一步发生;
(3)从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
(4)根据质量守恒定律,化学反应前后原子的种类和数目不变,每个X中含一个钠原子和一个氯原子,为氯化钠,化学式为NaCl.
故答案为:NaCl;
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体,其中Fe元素化合价由+3价变为+6价,则O元素化合价由-2价变为0价即有氧气生成,则反应的离子方程式为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
点评 本题考查化学反应原理,涉及电化学、氧化还原反应等相关知识,题中的Fe与NO3-的反应跟溶液酸碱性有关,抓住这一点是解题的关键,第Ⅱ问的解答有一定的难度,特别是阐述上的准确性,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g);③2NH3(g)?N2(g)+3H2(g).
达到平衡时,c(H2)=2mol/L,c(N2)=0.5mol/L,c(HI)=4mol/L,则平衡时 NH3的浓度为( )
| A. | 0.5 mol•L-1 | B. | 2 mol•L-1 | C. | 4 mol•L-1 | D. | 5 mol•L-1 |
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
| A. | 氯化氢分子的电子式: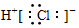 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: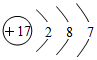 |
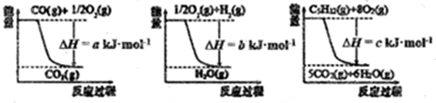
(1)如何获得廉价的氢气是合成氨工业中的重要课题.目前常用戊烷跟水蒸气反应的方法获得氨气:
C5H12(g)+5H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)
已知几个反应的能量变化如图所示,则上述反应的△H=c-5a-11bkJ•mol-1.
(2)利用氢气合成氨的反应原理为:3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g)现有甲、乙、丙3个固定容积为2L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表示:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
a.容器内混合气体的密度保持不变
b.3v 正(N2)=v 逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=0.05mol•L-1•min-1,该温度下,反应的平衡常数K=5.33L2•mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是ac(填序号).
a.c1>c3 b.w 1<w 2 c.ρ2>ρ1>ρ3???????
④在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是将产物混合气中的氨冷却分离后,剩余气体循环使用.
(3)一定条件下存在反应:H2(g)+I2(g)?2HI(g)△H<0,现有甲、乙两个完全相同的恒容绝热密闭容器,在甲中充入1molH2和1molI2(g),在乙中充入2molHI(g).同时在700℃条件下开始反应,达到平衡时有关说法正确的是
①容器甲中气体的正反应速率比容器乙中的快(填“快”、“慢”或“相同”)
②容器甲中气体的平衡常数比容器乙中的小(填“大”、“小”或“相等”)
③容器甲中气体的颜色比容器乙中的深(填“深”、“浅”或“相同”)
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题: