题目内容
6.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 用含1mol FeCl3的溶液制备成Fe(OH)3胶体,其中胶粒数为NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 常温常压下,14 g CO和N2的混合气体中,含有原子数为NA | |
| D. | 1 L 1 mol/L NH4Cl溶液中含有NH4+数为NA |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、金刚石中,每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:$\frac{1}{2}$×4=2,据此计算出1mol碳原子形成的共价键数目;
C、氮气和CO的摩尔质量均为28g/mol;
D、铵根离子为弱碱阳离子.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故生成的胶粒的个数小于NA个,故A错误;
B、金刚石为原子晶体,晶体中每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:$\frac{1}{2}$×4=2,12g金刚石中含有1mol碳原子,1molC能够形成2mol共价键,含有的共价键数为2NA,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合气体的物质的量为0.5mol,而两者又均为双原子分子,故0.5mol混合气体中含1mol原子即NA个,故C正确;
D、铵根离子为弱碱阳离子,在溶液中会水解,故个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
16.密度为1.45g/ml的H2SO4溶液中,逐滴加入BaCl2溶液,直到SO42-全部沉淀为止,已知沉淀的质量与原来H2SO4溶液的质量相等,则原来H2SO4溶液的浓度为( )
| A. | 29.6% | B. | 21% | C. | 6.22 mol/L | D. | 12.4mol/L |
17.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入过量的二氧化硫:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ | |
| B. |  溶液中加入过量的碳酸钠: 溶液中加入过量的碳酸钠: | |
| C. | 硝酸铁溶液中加入少量的氢碘酸2NO3-+8H++6I-=3I2+2NO+4H2O | |
| D. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液NH4++Al3++4OH-=NH3↑+Al(OH)3↓+H2O |
1.下列说法正确的是( )
| A. | 二氧化硫能使品红溶液褪色是因为SO2具有氧化性 | |
| B. | 新制氯水的氧化性强于久置氯水 | |
| C. | 检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 | |
| D. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
11.下列有关金属晶体和离子晶体的叙述中,不正确的是( )
| A. | 金属钠形成的晶体中,每个钠原子周围与其距离最近的原子有8个 | |
| B. | 金属镁形成的晶体中,每个镁原子周围与其距离最近的原子有6个 | |
| C. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有12个 | |
| D. | 在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个 |
18.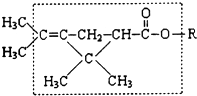 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
