题目内容
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA | |
| C. | 78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA | |
| D. | 标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
分析 A、铁变为Fe3O4时变为+$\frac{8}{3}$价;
B、NO2和N2O4的最简式均为NO2;
C、Na2S和Na2O2的摩尔质量均为78g/mol,且均由2个阳离子和1个阴离子构成;φφ
D、求出乙炔的物质的量,然后根据乙炔中含5条共价键来分析.
解答 解:A、铁变为Fe3O4时变为+$\frac{8}{3}$价,故3mol铁失去8NA个电子,故A正确;
B、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个原子,故B正确;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故78g混合物的物质的量为1mol,且两者均由2个阳离子和1个阴离子构成,故1mol混合物中含离子共3NA个,故C错误;
D、标况下2.24L乙炔的物质的量为0.1mol,而乙炔中含5条共价键,故0.1mol乙炔中含0.5NA条共价键,故D正确.
故选ABD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
10.维生素在人体内起到调节新陈代谢,预防疾病,维护身体健康的作用.患坏血症的人缺乏的维生素是( )
| A. | 维生素D | B. | 维生素C | C. | 维生素B | D. | 维生素A |
7.BaCO3与稀硝酸反应,正确的离子方程式是( )
| A. | Ba2++CO32-+2H+=Ba(NO3)2+H2O+CO2↑ | |
| B. | BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | BaCO3+2H++2NO3-=Ba(NO3)2+H2O+CO2↑ | |
| D. | CO32-+2H+=H2O+CO2↑ |
14.配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
| A. | 未冷却即转移、定容 | B. | 溶液转移后,未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 容量瓶中原有少量蒸馏水 |
4.化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 制作Fe(OH)3胶体时,应将蒸馏水与FeCl3溶液混合加热,煮沸至液体呈红褐色 | |
| C. | 各放一张质量相同的滤纸于天平两托盘上,将Na2CO3固体放在右盘纸上称量 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
11.下列有关实验的说法正确的是( )
| A. | 在制备乙烯实验中,为防止反应过于剧烈,加热时应使温度缓慢上升至170℃ | |
| B. | 向苯酚钠稀溶液中,不断通入足量二氧化碳气体,溶液最终不会出现浑浊现象 | |
| C. | 将溴乙烷滴入NaOH溶液后加热,待充分反应后,再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,同时在水浴中加热,三支试管中香味持续时间按加入氢氧化钠、稀硫酸、水的顺序依次增长 |
8.用系统命名法命名下列有机物,名称正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 2-乙基丁烷 |
3.下列有关沉淀溶解平衡的说法正确的是( )
| A. | Ksp(AB2)<Ksp(CD),则物质AB2的溶解度一定小于物质CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
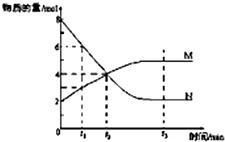 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: