题目内容
12.有2g镁铝合金,与足量的HCl反应,生成气体2.24L,求该合金中镁、铝的质量比.分析 设出混合物中镁和铝的物质的量,然后分别根据总质量、电子守恒列式计算,最后根据m=nM计算出合金中二者的质量之比.
解答 解:设合金中含有Mg、Al的物质的量分别为x、y,
根据合金的总质量可得:24x+27y=2,
根据电子守恒可知:2x+3y=$\frac{2.24}{22.4}$×2,
联立解得:x=$\frac{1}{30}$mol、y=$\frac{2}{45}$mol,
所以合金中镁、铝的质量之比为:($\frac{1}{30}$mol×24g/mol):$\frac{2}{45}$mol×27g/mol=2:3,
答:镁、铝的质量比为2:3.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3. 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
①将14.2g Na2SO4溶于100mL水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100mL
③定容时俯视容量瓶刻度线导致浓度偏大
④摇匀后发现液面低于刻度线需再加水至刻度线.
 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )①将14.2g Na2SO4溶于100mL水中
②将20ml 5.0mol/L Na2SO4溶液用水稀释至100mL
③定容时俯视容量瓶刻度线导致浓度偏大
④摇匀后发现液面低于刻度线需再加水至刻度线.
| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
7.下列说法正确的是( )
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 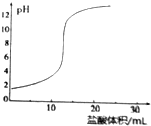 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
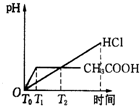
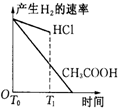
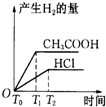
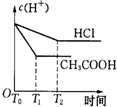
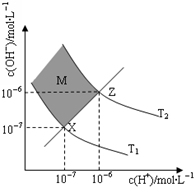 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0