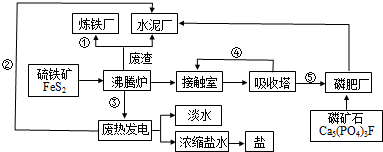
题目内容
16.下列物质能导电的是AE;属于电解质的是CFI;属于非电解质的是DGH;既不是电解质又不是非电解质的是ABE.A.汞 B.氯气C.CaO D.SO2 E.盐酸 F.氯化钠 G.乙醇H.蔗糖I.氢氧化钡.
分析 当物质中有自由移动的离子或电子时,则物质能导电;
电解质是在水溶液中或熔融状态下能导电的化合物;
在水溶液中和熔融状态下均不能导电的化合物为非电解质.据此分析.
解答 解:A.汞是金属单质,能导电,既不是电解质也不是非电解质;
B.氯气不能导电,是单质,既不是电解质也不是非电解质;
C.氧化钙在熔融状态时能导电,是化合物,属于电解质;
D.二氧化硫不能导电,在水溶液中和熔融状态下均不能导电,故为非电解质;
E.盐酸溶液能导电,但由于是混合物,故既不是电解质也不是非电解质;
F.氯化钠溶液和熔融的氯化钠都能导电,所以氯化钠属于电解质,但是NaCl固体不导电;
G.乙醇不能导电,在水溶液中和熔融状态下均不能导电,故为非电解质;
H.蔗糖不能导电,在水溶液中和熔融状态下均不能导电,故为非电解质;
I.氢氧化钡不能导电,但在水溶液中和熔融状态下完全电离而导电,故为电解质;
故答案为:AE;CFI;DGH;ABE.
点评 本题考查电解质与非电解质、物质的导电性,解答该类概念性题目,应对概念十分清晰.抓住概念中的关键词,并注意大多数有机化合物都是非电解质,强电解质必须能完全电离,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向明矾溶液中溶液中加入足量的浓氨水 | 证明氢氧化铝溶于氨水 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向硅酸钠溶液中通入足量的CO2出现白色沉淀. | 酸性:H2CO3>H2SiO3 |
| D | 室温下,用pH试纸测得:0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是 ( )
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
1.以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料可制备金属镁和溴.流程如图1:
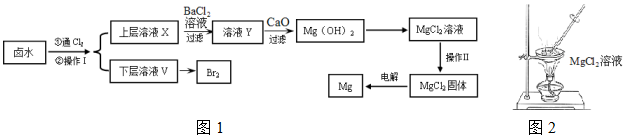
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
(5)操作Ⅱ用图2所示操作不能实现(填“能”或“不能”).原因是MgCl2+2H2O?Mg(OH)2+2HCl(用化学方程式解释).
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl2+2Br-=2Cl-+Br2.
(3)证明SO42-完全沉淀的方法是静置向上层清液中继续加入BaCl2溶液,若不产生白色沉淀则证明SO42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg2++2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑(用离子方程式表示).
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl电离出的NH4+与OH?结合成弱电解质一水合氨,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
5.涤纶广泛应用于衣料和装饰材料.合成涤纶的反应如下:n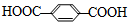 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
 +nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )
+nHOCH2CH2OH$\stackrel{一定条件}{→}$涤纶+(2n-1)H2O下列说法正确的是( )| A. | 合成涤纶的反应为加聚反应 | |
| B. | 对苯二甲酸和苯甲酸互为同系物 | |
| C. | 1 mol涤纶与NaOH溶液反应,理论上最多可消耗2n mol NaOH | |
| D. | 涤纶的结构简式为: |
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空: