题目内容
18.小华同学欲以过氧化氢(H2O2)的分解反应来探究影响化学反应速率的条件.(1)表是小华的一组探究数据,请回答相关问题:
表:在不同条件下用10mL H2O2制取150mLO2所需的时间(秒)
 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| 有催化剂、不加热 | 10 | 25 | 60 | 120 |
②从上述设计方案中,请任选一个,说明小华的探究结论:升高温度反应速率加快
(2)表是小华的又一组探究数据,请回答相关问题:
| 实验操作 | MnO2状态 | 观察结果 | 反应所需时间 |
| 将MnO2加入5mL5%过氧化氢溶液中,不震荡 | 粉末状 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
②本实验的探究目的是催化积的表面积对反应速率的影响.
分析 (1)①从表中数据看出,小华在设计方案时,考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响;
②浓度相同时,无催化剂不加热,几乎不反应,而无催化剂加热,需要360秒,说明升高温度,反应速率加快;
(2)①带火星的木条复燃,说明双氧水在二氧化锰作催化剂的作用下产生了氧气;
②过氧化氢溶液的浓度一样,催化剂的表面积大的,反应更剧烈,说明本实验探究的是催化积的表面积对反应速率的影响.
解答 解:(1)①从表中数据看出,小华在设计方案时,考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响,
故答案为:浓度、催化剂、温度;
②浓度相同时,无催化剂不加热,几乎不反应,而无催化剂加热,需要360秒,说明升高温度,反应速率加快,
故答案为:升高温度反应速率加快;
(2)①带火星的木条复燃,说明双氧水在二氧化锰作催化剂的作用下产生了氧气,反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②过氧化氢溶液的浓度一样,催化剂的表面积大的,反应更剧烈,说明本实验探究的是催化积的表面积对反应速率的影响,
故答案为:催化积的表面积对反应速率的影响.
点评 本题通过图表数据,考察了外界条件对反应速率的影响,要注意分析其他条件相同,只有一个条件改变时,如何影响反应速率,难度不大.

练习册系列答案
相关题目
10.氨既是重要工业产品又是化工原料,由氨可以制备一系列物质(见图),下列说法正确的是( )
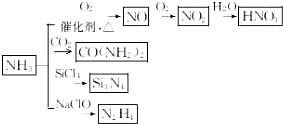

| A. | 图中所述反应都发球氧化还原反应 | |
| B. | CO(NH2)2与氰酸铵(NH4CNO)互为同素异形体 | |
| C. | Si3N4属于离子化合物 | |
| D. | NH3与NaClO反应,N2N4是氧化产物 |
6. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中NO3-物质的量为0.2mol | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | H2SO4浓度为4mol•L-1 |
3.检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液 ②加入NaOH溶液加热 ③加入适量HNO3 ④冷却.
①加入AgNO3溶液 ②加入NaOH溶液加热 ③加入适量HNO3 ④冷却.
| A. | ①②④③ | B. | ②④③① | C. | ②④① | D. | ②③④① |
10.下列操作错误的是( )
| A. | 若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 | |
| B. | 在实验室中使用金属钠时若不慎着火,可立即用细沙灭火 | |
| C. | 用带有玻璃塞的玻璃瓶盛放NaOH溶液 | |
| D. | 测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上 |
7.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如式 ,则下列说法错误的是( )
,则下列说法错误的是( )
 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C10H18O |
