题目内容
12.25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.分析 25℃时pH=6的溶液中c(H+)=1×10-6mol•L-1,c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-6}}$mol/L=1×10-8mol•L-1,根据电荷守恒可知c(CH3COO-)-c(Na+)=c(H+)-c(OH-);根据醋酸的电离平衡常数可知$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$,据此进行计算.
解答 解:25℃时pH=6的溶液中c(H+)=1×10-6mol•L-1,c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-6}}$mol/L=1×10-8mol•L-1,
溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据电荷守恒可知:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1×10-6mol•L-1-1×10-8mol•L-1=9.9×10-7mol•L-1;
已知25℃时CH3COOH的 Ka=1.8×10-5,通过电离平衡常数的表达式可知:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$=$\frac{1.8×1{0}^{-5}}{1×1{0}^{-6}}$=18,
故答案为:9.9×10-7;18.
点评 本题考查了弱电解质在水溶液中的电离平衡,题目难度中等,明确电离平衡常数的概念为解答关键,注意掌握电荷守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
2. 向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
 向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )
向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( )| A. | OA段产生的是NO和H2的混合气 | B. | BC段产生的全部是NO | ||
| C. | Fe2(SO4)3是最终的溶质 | D. | H2SO4的物质的量浓度是2 mol/L |
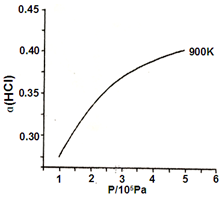 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.