题目内容
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |
考点:原子轨道杂化方式及杂化类型判断
专题:
分析:A.分子中中心原子通过sp2杂化轨道成键时,如果存在孤电子对,则该分子空间构型不是平面三角形;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键;
D.硫酸分子中S原子为sp3杂化.
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键;
D.硫酸分子中S原子为sp3杂化.
解答:
解:A.分子中中心原子通过sp2杂化轨道成键时,如果存在孤电子对,则该分子空间构型不是平面三角形,如果没有孤电子对,则分子空间构型为平面三角形,故A正确;
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键,π键是肩并肩形成的,故B正确;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键,所以分子中有1个σ键、2个π键,故C正确;
D.H2SO4硫酸分子中S原子为sp3杂化,O-H为共用电子对形成的化学键,不是以杂化轨道成键,故D错误;
故选D.
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子,不能形成π键,π键是肩并肩形成的,故B正确;
C.氮气分子中N原子之间存在3对共用电子对,一个头对头、两个肩并肩形成化学键,所以分子中有1个σ键、2个π键,故C正确;
D.H2SO4硫酸分子中S原子为sp3杂化,O-H为共用电子对形成的化学键,不是以杂化轨道成键,故D错误;
故选D.
点评:本题考查杂化轨道和杂化理解,侧重考查对基本概念、基本理论的理解,知道原子杂化方式的判断方法,为高考热点,题目难度中等.

练习册系列答案
相关题目
下列有机物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
①CH3Cl② ③
③ ④
④
①CH3Cl②
 ③
③ ④
④
| A、①② | B、②③④ |
| C、② | D、①②③④ |
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2 在石墨电极上发生氧化反应 |
| C、石墨电极上的电极反应式为:H2O2+2e-=2OH- |
| D、导线中电子由正极流向负极,溶液中Cl-向正极移动 |

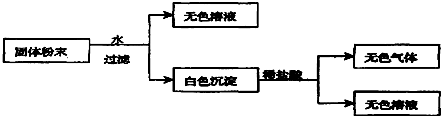

 用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
用试纸检验气体性质是一种重要的实验方法.如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )