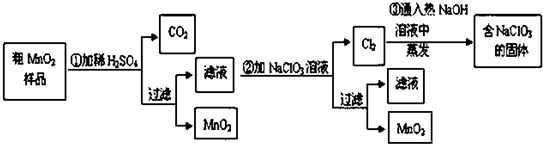
题目内容
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 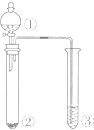 |
| A | 浓盐酸 | KMnO4 | AgNO3 | 说明氯气能与硝酸银反应产生白色沉淀 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.浓盐酸易挥发;
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀.
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀.
解答:
解:A.浓盐酸易挥发,可与氯气生成氯化银沉淀,故A错误;
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色,按照图中装置发生的实验现象能说明浓硫酸的性质,故B正确;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,但SO2与可溶性钡盐不一定生成白色沉淀,如与氯化钡不反应,故C错误;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,故D错误;
故选B.
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色,按照图中装置发生的实验现象能说明浓硫酸的性质,故B正确;
C.盐酸与亚硫酸钠生成二氧化硫,与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,但SO2与可溶性钡盐不一定生成白色沉淀,如与氯化钡不反应,故C错误;
D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的干扰,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及浓盐酸的性质、酸性比较、氧化还原反应等,把握化学反应原理及实验装置中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
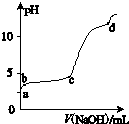 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
下列实验装置或操作与粒子的大小有直接关系的是( )
A、 蒸馏 |
B、 蒸发 |
C、 萃取 |
D、 丁达尔效应 |
下列有机物在一定条件下,既能发生消去反应,又能发生水解反应的是( )
①CH3Cl② ③
③ ④
④
①CH3Cl②
 ③
③ ④
④
| A、①② | B、②③④ |
| C、② | D、①②③④ |