题目内容
1.下列微粒中,最外层电子数最多的是( )| A. | Ne | B. | Al3+ | C. | Fe | D. | Fe2+ |
分析 主族元素原子的最外层电子数=族序数,失去最外层电子变为离子时最外层电子数等于原子的次外层电子数,结合电子排布判断最外层电子数,以此来解答.
解答 解:A.Ne的质子数为10,有2个电子层,最外层电子数为8,故A不选;
B.Al3+的核外电子数为10,有2个电子层,最外层电子数为8,故B不选;
C.Fe原子核外电子排布式为[Ar]3d64s2,最外层电子数为2,故C不选;
D.Fe2+的电子排布式为[Ar]3d6,最外层电子数为18,故D选;
故选D.
点评 本题考查原子核外电子排布,为高频考点,把握电子排布规律、能量最低原理为解答的关键,侧重分析与应用能力的考查,注意离子的最外层电子数判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
12.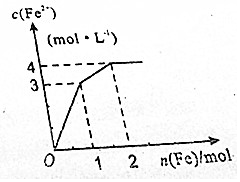 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
16.700℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g),反应过程中测定的部分数据见表:下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2)/mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A. | 反应在20 min内的平均速率为v(H2)=0.04 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于$\frac{1}{3}$ |
6.实验中的下列操作正确的是( )
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
13.甲、乙两烧瓶中各盛有200mL 3mol•L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲:乙=2:3(相同状况),则加入铝粉的质量为( )
| A. | 8.1g | B. | 3.6g | C. | 4.05g | D. | 2.7g |
10.表一是某种常见金属的部分性质:
表一:
将该金属投入到稀盐酸中,可产生大量的无色气体.根据上述信息回答下列问题:
(1)推断该金属的一种用途是做导线.
(2)该金属的活动性比铜强(填“强”或“弱”).
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱,并完成下表二:
表二:
表一:
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
(1)推断该金属的一种用途是做导线.
(2)该金属的活动性比铜强(填“强”或“弱”).
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱,并完成下表二:
表二:
| 一种猜想 | 验证方法 | 现象 | 结论 |
11.我国预计在2020年前后建成自己的载人空间站.为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2.关于该装置的下列说法不正确的是( )
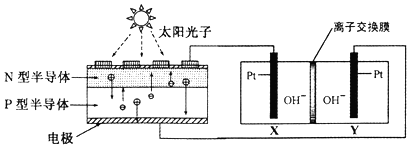

| A. | 图中N型半导体为负极,P型半导体为正极 | |
| B. | 图中离子交换膜为阴离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O=CO+2OH- |