题目内容
20.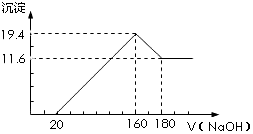 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)写出将固体混合物投入稀盐酸中所发生的氧化还原反应的离子方程式:2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑;
(2)写出加入NaOH的体积为160~180mL时反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O;
(3)计算在反应过程中放出的气体在标准状况下的体积为7.84;
(4)原固体混合物的质量为7.5g;
(5)所用盐酸的物质的量浓度.
分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.当V(NaOH溶液)=160mL时,沉淀量最大,此时生成Mg(OH)2和Al(OH)3沉淀,沉淀质量为19.4g,溶液中溶质为NaCl,根据钠元素守恒可知此时n(NaCl)等于160mL氢氧化钠溶液中含有的n(NaOH);从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,其质量为11.6g,n(Mg(OH)2)=$\frac{11.6g}{58g/mol}$=0.2mol,则沉淀量最大是Mg(OH)2为11.6g,Al(OH)3为19.4g-11.6g=7.8g,n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol,据此进行解答.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.当V(NaOH溶液)=160mL时,沉淀量最大,此时生成Mg(OH)2和Al(OH)3沉淀,沉淀质量为19.4g,溶液中溶质为NaCl,根据钠元素守恒可知此时n(NaCl)等于160mL氢氧化钠溶液中含有的n(NaOH);从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,其质量为11.6g,n(Mg(OH)2)=$\frac{11.6g}{58g/mol}$=0.2mol,则沉淀量最大是Mg(OH)2为11.6g,Al(OH)3为19.4g-11.6g=7.8g,n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol;由于从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.1mol,氢氧化钠的浓度为$\frac{0.1mol}{0.18L-0.16L}$=5mol/L,
(1)将固体混合物投入稀盐酸中,所发生的氧化还原反应的离子方程式有:Mg与HCl反应、Al与HCl反应,反应的离子方程式分别为2Al+6H+=2Al3++3H2↑,Mg+2H+=Mg2++H2↑,
故答案为:2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑;
(2)由图象可知,从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)混合物中含有0.2molMg、0.1molAl,根据电子守恒可知生成氢气的物质的量为:$\frac{0.2mol×2+0.1mol×3}{2}$=0.35mol,标准状况下0.35mol氢气的体积为:22.4L/mol×0.35mol=7.84L,
故答案为:7.84L;
(4)混合物中含有0.2molMg、0.1molAl,则混合物的质量为:24g/mol×0.2mol+0.1mol×27g/mol=7.5g,
故答案为:7.5g;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为$\frac{0.8mol}{0.1L}$=8mol/L,
答:所用盐酸的物质的量浓度为8mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线对应的反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
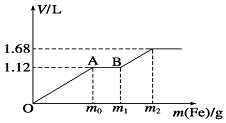 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
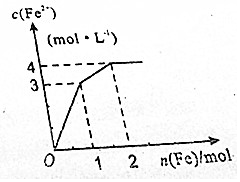 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
表一:
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
(1)推断该金属的一种用途是做导线.
(2)该金属的活动性比铜强(填“强”或“弱”).
(3)请自选试剂,设计实验探究该金属与铁的活动性的强弱,并完成下表二:
表二:
| 一种猜想 | 验证方法 | 现象 | 结论 |