题目内容
9.有机化合物A(C5H8O2)不溶于水,并可以发生如图所示的变化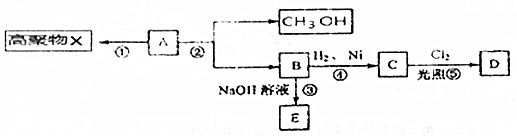
已知:C物质的一氯代物D只有两种同分异构体,请回答:
(1)A分子中含有的官能团的名称酯基、碳碳双键
(2)①②④⑤反应中属于取代反应的有②⑤(填序号).
(3)写出②的反应方程式CH2=C(CH3)COOCH3+H2O$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+CH3OH.
(4)写出一种下列要求的物质的同分异构体的结构简式
①C的同分异构体中属于酯且能发生银镜反应HCOOCH2CH2CH3.
②C的同分异构体中属于醇且能发生银镜反应CH2OHCH2CH2CHO.
(5)简述验证D中含有氯元素的方法取少量的D向其中加入氢氧化钠溶液,加热煮沸,再加入硝酸酸化,滴入硝酸银溶液,有白色沉淀生成,证明含有氯元素.
(6)17.2g B与足量的碳酸氢钠溶液反应,标准状况下生成二氧化碳的体积为4.48L.
分析 有机化合物A(C5H8O2)不溶于水,A转化得到甲醇与B,应是发生酯的水解反应,说明A属于酯,B能与氢氧化钠溶液反应,则B属于羧酸,A可以形成高聚物X,结合A的分子式,说明A还含有碳碳双键;A水解过程中破坏的只是酯基,而碳碳双键保留了下来,B中应还含有C=C双键,B能与氢气发生加成反应也说明了B含有C=C双键,根据A的分子中有5个碳原子,而它水解又生成了甲醇和B,因此B中有4个碳原子,B转化成C的过程中没有碳原子的变化,即C中也只有4个碳原子,C的一氯代物D有两种,得出C的结构简式为CH3CH(CH3)COOH,故B为CH2=C(CH3)COOH,A为CH2=C(CH3)COOCH3,A加聚反应生成高聚物X的结构简式是: ,以此解答该题.
,以此解答该题.
解答 解:(1)由上述分析可知,A为CH2=C(CH3)COOCH3,A分子中含有的官能团:酯基、碳碳双键,故答案为:酯基、碳碳双键;
(2)反应①属于加聚反应,反应②⑤属于取代反应,反应④属于加成反应,故答案为:②⑤;
(3)反应②是CH2=C(CH3)COOCH3在浓硫酸、加热条件下水解生成甲醇与CH2=C(CH3)COOH,反应方程式为:CH2=C(CH3)COOCH3+H2O$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+CH3OH,
故答案为:CH2=C(CH3)COOCH3+H2O$→_{△}^{浓硫酸}$CH2=C(CH3)COOH+CH3OH;
(4)C的结构简式为CH3CH(CH3)COOH,对应的同分异构体中属于酯且能发生银镜反应,应为甲酸酯,可为HCOOCH2CH2CH3、HCOOCH(CH3)2,
同分异构体中属于醇且能发生银镜反应,应含有羟基和醛基,可为CH2OHCH2CH2CHO等,
故答案为:HCOOCH2CH2CH3;CH2OHCH2CH2CHO;
(5)检验D中含有氯元素的方法为:取少量的D向其中加入氢氧化钠溶液,加热煮沸,再加入硝酸酸化,滴入硝酸银溶液,有白色沉淀生成,证明含有氯元素,
故答案为:取少量的D向其中加入氢氧化钠溶液,加热煮沸,再加入硝酸酸化,滴入硝酸银溶液,有白色沉淀生成,证明含有氯元素;
(6)为CH2=C(CH3)COOH,17.2gB的物质的量为$\frac{17.2g}{86g/mol}$=0.2mol,与足量的碳酸氢钠溶液反应,生成二氧化碳为0.2mol,标准状况下生成二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48.
点评 本题考查有机物的推断,为高考常见题型,涉及酯、烯、羧酸等性质与转化,难度中等,利用正推法与逆推法结合推断,关键是根据反应判断A含有的官能团,再结合C的一氯代物有两种,得出C的结构简式.

| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
(1)X单质的电子式是
 .
.(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)W、Z形成的化合物的水溶液的pH<(填“>”“<”或“=”)7,理由是Al3++3H2O?Al(OH)3+3H+ (用离子方程式表示).
(4)8g Y的最简单氢化物完全燃烧生成液态水时放出445kJ的热量,写出Y的最简单氢化物的燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1.
| A. | SO2 | B. | H2SiO3 | C. | Na2CO3 | D. | NaOH |
| A. | 氯气和水反应:Cl2+H2O?H++Cl-+HClO | |
| B. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 少量二氧化硫气体通入FeCl3溶液中:2Fe3++SO2+2H2O═2Fe2++4H++SO42- |
| A. | 25℃、l0IKPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol白磷(P4)分子中所含化学键的数目为4NA | |
| D. | 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA |
| A. |  装置可以用来验证碳的非金属性比硅强 | |
| B. | 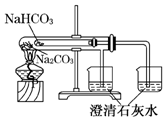 装置可以用来比较Na2CO3和NaHCO3的热稳定性 | |
| C. |  装置先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体 | |
| D. | 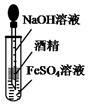 装置制备Fe(OH)2并能保证较长时间观察到白色 |
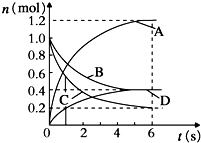
| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
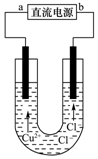
| A. | a端是直流电源的正极 | |
| B. | 阴极上发生的反应:Cu2++2e-=Cu | |
| C. | 通电使CuCl2发生电离 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |