题目内容
9.医学上,科学家们设计以Pt和Zn为电极材料的电池,植入人体内作为心脏病患者的心脏起搏器的能源,它依靠人体内体液中存在的一定浓度的溶解的O2、H+、Zn2+进行工作.下列叙述正确的是( )| A. | Pt为负极,Zn为正极 | |
| B. | Zn为负极,Pt为正极 | |
| C. | 负极反应式为Zn-2e-═Zn2+,正极反应式为2H++2e-═H2↑ | |
| D. | 负极反应式为Zn-2e-═Zn2+,正极反应式为O2+2H2O+4e-═4OH- |
分析 该原电池中,Zn易失电子作负极、Pt作正极,负极上电极反应式为Zn-2e-═Zn2+,正极反应式为O2-4e-+4H+=2H2O,据此分析解答.
解答 解:该原电池中,Zn易失电子作负极,则Pt作正极,负极上Zn失电子发生氧化反应,正极上氧气得电子和氢离子反应生成水,则负极电极反应式为Zn-2e-═Zn2+,正极反应式为O2-4e-+4H+=2H2O,
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确正负极判断方法、各个电极上发生的反应是解本题关键,易错点是电极反应式的书写,要结合电解质溶液酸碱性书写.

练习册系列答案
相关题目
19.下列有机物中,既能发生加成反应和酯化反应,又能发生氧化反应的是( )
| A. | CH3CH2COOH | B. | CH3CH2CH2OH | C. | CH2CHCOOCH3 | D. | HOCH2CH2CHO |
20.下列关于原电池的叙述正确的是( )
| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
17.常温下,浓度均为0.1mlo•L-1的HX、HY溶液各20mL,分别用0.1mol•L-1的Na0H溶液滴定.溶液的pH与所用Na0H的体积V关系如图所示,下列推断不正确的是( )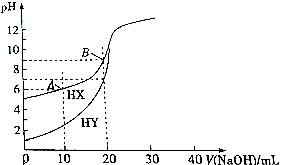

| A. | 相同条件下,HX和HY中和碱的能力相同 | |
| B. | 常温下,HX的电离平衡常数K=1×10-9mol•L-1 | |
| C. | 点存在:c(X-)-c(HX)>c(H+)-c(0H-) | |
| D. | 向B点溶液通人HCl气体至中性:c(HX)+c(Cl-)+2c(X-)=0.2mol•L-1A |
4.我国汉书中记载:“高奴县有洧水,可燃”,沈括在《梦溪笔谈》对洧水的使用有如下描述:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也”,对上述史实记载分析正确的是( )
| A. | 该物质属于纯净物 | B. | 该物质可能属于无机化合物 | ||
| C. | 该物质是由同一类烃组成的混合物 | D. | 烟是该物质不完全燃烧的产物 |
14.下列化学用语正确的是( )
| A. | 双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O | |
| B. | HClO4的电离方程式:HClO4=H++ClO4- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | Fe2+被空气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
1.下列离子能大量共存的是( )
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
2.用质量相同的铁单质与下列条件下相同体积的硫酸反应时,生成氢气速率最快的是( )
| A. | 20℃铁片 1mol/L硫酸 | B. | 30℃铁粉 1mol/L硫酸 | ||
| C. | 30℃铁粉 2mol/L硫酸 | D. | 30℃铁片 18mol/L硫酸 |