题目内容
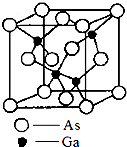 砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.
砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.(1)AsH3是一种无色可溶于水的气体,其分子空间构型为
(2)镓(Ga)在元素周期表中的位置为,其价电子排布式为
(3)以AsH3为原料,在700~900℃下通过化学气相沉积来制造半导体材料砷化镓(GaAs)的化学方程式为Ga(CH3)3+AsH3=GaAs+3X.X的结构简式为
(4)砷酸为砷(As)的含氧酸,其分子式为H3AsO4,结构类似于磷酸.AsO43-中,As的杂化类型为
(5)砷化镓晶胞如图所示,若镓原子位于立方体内,则砷原子位于立方体的,砷的配位数为,设该晶胞的边长为a nm,NA为阿伏加德罗常数的数值,则砷化镓晶体的密度为
考点:晶胞的计算,原子核外电子排布,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)As为ⅤA族元素,最外层有5个电子,形成的AsH3中有一对孤电子对,结构与氨分子相似,所以AsH3的空间构型为三角锥形,据此答题;
(2)镓(Ga)是31号元素,位于周期表中第ⅢA族第四周期,其价电子有3个,其排布式为:4s24p1,据此答题;
(3)根据元素守恒推断X的化学式,进而写出结构简式;
(4)根据AsO43-中心原子的价层电子对数,可以推得杂化类型;
(5)根据ρ=
计算晶胞的密度.
(2)镓(Ga)是31号元素,位于周期表中第ⅢA族第四周期,其价电子有3个,其排布式为:4s24p1,据此答题;
(3)根据元素守恒推断X的化学式,进而写出结构简式;
(4)根据AsO43-中心原子的价层电子对数,可以推得杂化类型;
(5)根据ρ=
| m |
| V |
解答:
解:(1)As为ⅤA族元素,最外层有5个电子,形成的AsH3中有一对孤电子对,结构与氨分子相似,所以AsH3的空间构型为三角锥形,故答案为:三角锥形;
(2)镓(Ga)是31号元素,位于周期表中第ⅢA族第四周期,其价电子有3个,其排布式为:4s24p1,故答案为:s24p1;
(3)在反应Ga(CH3)3+AsH3=GaAs+3X中,根据元素守恒可得X的化学式为:CH4,结构简式为CH4;故答案为:CH4;
(4)根据AsO43-中心原子的价层电子对数为
=4,所以As原子的杂化方式为sp3杂化,故答案为:sp3杂化;
(5)在砷化镓晶胞中,砷原子数目为8×
+6×
=4根,镓原子数为4,根据据ρ=
可知晶胞的密度=
g/cm3=
g/cm3,故答案为:
g/cm3.
(2)镓(Ga)是31号元素,位于周期表中第ⅢA族第四周期,其价电子有3个,其排布式为:4s24p1,故答案为:s24p1;
(3)在反应Ga(CH3)3+AsH3=GaAs+3X中,根据元素守恒可得X的化学式为:CH4,结构简式为CH4;故答案为:CH4;
(4)根据AsO43-中心原子的价层电子对数为
| 5+3 |
| 2 |
(5)在砷化镓晶胞中,砷原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| (a×10-7)3 |
| 0.96 |
| a3 |
| 0.96 |
| a3 |
点评:本题考查了分子空间构型、价电子排布、原子杂化方式、晶胞密度的计算,难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列化学式既能表示物质的组成,又能表示物质的分子式的是( )
| A、NH4NO3 |
| B、SiO2 |
| C、CCl4 |
| D、Cu |
下列说法正确的是①油脂没有固定的熔沸点②油脂都不能使溴水褪色③食用油属于酯类,石蜡油属于烃类④油脂属于天然高分子化合物( )
| A、都正确 | B、只有①③ |
| C、只有①②③ | D、只有②④ |
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )


| A、装置中出口①处的物质是氯气,出口②处的物质是氢气 | ||||
B、装置中发生反应的离子方程式为:2Cl-+2H+
| ||||
| C、该装置是将电能转化为化学能 | ||||
| D、该离子交换膜只能让阳离子通过,不能让阴离子通过 |
把a L含(NH4)2SO4和NH4NO3的混合溶液分成两等份.一份用bmol烧碱刚好把氨全部赶出;另一份与BaCl2溶液完全反应,消耗c mol BaCl2,则原溶液中c(NO3-)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
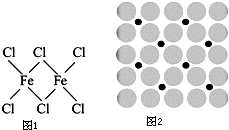 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题: