题目内容
 铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:
铁及铁的化合物在生产、生活中有广泛应用.请回答下列问题:(1)基态Fe2+的最外层电子排布式为
(2)工业上常利用Fe2+与CN-形成稳定Fe(CN)64-(六氰合亚铁离子)的特点来处理含CN-的工业废水.在CN-中C原子的杂化方式为
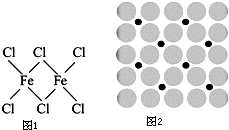
(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂.其在300℃以上易升华,在400℃时它的蒸气中有以配位键结合的双聚分子存在,其结构如图1所示.请判断三氯化铁的晶体类型为
(4)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为
(5)当温度低于912℃时,铁以体心立方的α-Fe晶型存在;当温度介于912℃~1394℃之间时,铁以面心立方的γ-Fe晶型存在.已知α-Fe的密度为7.86g/cm3,则γ-Fe的密度为
考点:晶胞的计算,原子核外电子排布,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)Fe是26号元素,根据原子核外电子排布规律可知,Fe2+的基态核外电子排布式为1s22s22p63s23p63d6,所以Fe2+的最外层电子排布式为3s23p63d6,据此答题;
(2)因为CN-与N2互为等电子体,据此可推知其电子式为: ,并可判断碳原子的杂化方式;
,并可判断碳原子的杂化方式;
(3)根据三氯化铁的性质可以判断其晶体类型,根据其结构式及氯原子满足八电子稳定结构,可画出配位键的位置;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,据此答题;
(5)根据两种晶胞的空间利用率可以算出两种晶体的密度关系,根据密度=
,计算晶胞体积及连长,根据晶胞的边长和铁原子半径的关系计算铁原子半径.
(2)因为CN-与N2互为等电子体,据此可推知其电子式为:
 ,并可判断碳原子的杂化方式;
,并可判断碳原子的杂化方式;(3)根据三氯化铁的性质可以判断其晶体类型,根据其结构式及氯原子满足八电子稳定结构,可画出配位键的位置;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,据此答题;
(5)根据两种晶胞的空间利用率可以算出两种晶体的密度关系,根据密度=
| 质量 |
| 体积 |
解答:
解:(1)Fe是26号元素,根据原子核外电子排布规律可知,Fe2+的基态核外电子排布式为1s22s22p63s23p63d6,所以Fe2+的最外层电子排布式为3s23p63d6,
故答案为3s23p63d6;
(2)因为CN-与N2互为等电子体,据此可推知其电子式为: ,并可判断碳原子的杂化方式为sp杂化;
,并可判断碳原子的杂化方式为sp杂化;
(3)因为三氯化铁在300℃以上易升华,由此可以判断其晶体类型为分子晶体,根据其结构式及氯原子满足八电子稳定结构,可画出配位键的位置如图所示: ,故答案为:分子晶体;
,故答案为:分子晶体;  ;
;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子的铁原子数为4×
=2,所以氮原子与铁原子的个数比为1:2,故答案为1:2;
(5)因为体心立方结构的空间利用率为74%,而面心立方结构的空间利用率为68%,所以γ-Fe与α-Fe的密度之比为:74%:68%,所以γ-Fe的密度为:
×7.86=8.55,在α-Fe的晶胞中因为是体心立方结构,所以含有铁原子数为1+8×
=2,根据密度=
,设晶胞连长为a,则有
=7.86,所以a=
,在体心立方结构中,立方体的体对角线的长度应等于铁原子半径的4倍,而体对角线的长度=
a,所以铁原子的半径为:
×
故答案为:8.55;
×
.
故答案为3s23p63d6;
(2)因为CN-与N2互为等电子体,据此可推知其电子式为:
 ,并可判断碳原子的杂化方式为sp杂化;
,并可判断碳原子的杂化方式为sp杂化;(3)因为三氯化铁在300℃以上易升华,由此可以判断其晶体类型为分子晶体,根据其结构式及氯原子满足八电子稳定结构,可画出配位键的位置如图所示:
 ,故答案为:分子晶体;
,故答案为:分子晶体;  ;
;(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子的铁原子数为4×
| 1 |
| 2 |
(5)因为体心立方结构的空间利用率为74%,而面心立方结构的空间利用率为68%,所以γ-Fe与α-Fe的密度之比为:74%:68%,所以γ-Fe的密度为:
| 74% |
| 68% |
| 1 |
| 8 |
| 质量 |
| 体积 |
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
点评:本题主要考查核外电子排布、等电子体、配位键、晶胞密度的计算等知识点,有一定的综合性,中等难度,解题时要熟记金属晶体的晶胞结构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关试剂的保存方法,错误的是( )
| A、金属钠保存在煤油中 |
| B、新制的氯水保存在无色广口瓶中 |
| C、NaOH溶液保存在带胶塞的玻璃试剂瓶中 |
| D、存放FeSO4溶液时加入少量铁粉 |
 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A、反应的化学方程式为4X?Y |
| B、当t1=2时,用X表示该反应在2min内的平均反应速率为0.25mol/(L?min) |
| C、t2时,正反应速率等于逆反应速率 |
| D、t3时,Y浓度不再变化,反应达到平衡 |
 (1)如图是维生素A的分子结构:
(1)如图是维生素A的分子结构: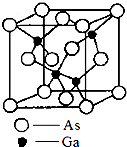 砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.
砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件. 有机物M的结构简式如图所示.
有机物M的结构简式如图所示.