题目内容
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)元素E的基态原子电子排布式,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有 种
(2)D、E两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态D2+再失去一个电子比气态E2+再失去一个电子难.对此,你的解释是 ;
(3)B单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.晶胞中B原子的配位数为,一个晶胞中B原子的数目为 .
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | ||||||||||||||||
(1)元素E的基态原子电子排布式,与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素有
(2)D、E两元素的部分电离能数据列于下表:

| 元素 | D | E | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)B单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.晶胞中B原子的配位数为,一个晶胞中B原子的数目为
考点:晶胞的计算,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)根据元素周期表可知D元素为锰元素,25号元素,最外层电子数为2,在第四周期中最外层电子数为2的元素还有钙、钪、钛、钒、铁、钴、镍、锌八种,据此答题;
(2)根据元素周期表可知E元素为铁元素,Mm2+的价电子排布式为3d5,为半充满稳定状态,而Fe2+的价电子排布式为3d6,未达稳定结构,而失去一个电子后也成为稳定结构,据此答题;
(3)根据均摊法计算晶胞中原子个数.
(2)根据元素周期表可知E元素为铁元素,Mm2+的价电子排布式为3d5,为半充满稳定状态,而Fe2+的价电子排布式为3d6,未达稳定结构,而失去一个电子后也成为稳定结构,据此答题;
(3)根据均摊法计算晶胞中原子个数.
解答:
解:(1)根据元素周期表可知D元素为锰元素,25号元素,最外层电子数为2,在第四周期中最外层电子数为2的元素还有钙、钪、钛、钒、铁、钴、镍、锌八种,
故答案为:8;
(2)根据元素周期表可知E元素为铁元素,Mm2+的价电子排布式为3d5,为半充满稳定状态,而Fe2+的价电子排布式为3d6,未达稳定结构,而失去一个电子后也成为稳定结构,故答案为:Mm2+的最外层已达稳定结构,而Fe2+的最外层未达稳定结构,失去一个电子后成为稳定结构;
(3)根据元素周期表可知B为铝元素,根据均摊法计算晶胞中铝原子个数为8×
+6×
=4,故答案为:4.
故答案为:8;
(2)根据元素周期表可知E元素为铁元素,Mm2+的价电子排布式为3d5,为半充满稳定状态,而Fe2+的价电子排布式为3d6,未达稳定结构,而失去一个电子后也成为稳定结构,故答案为:Mm2+的最外层已达稳定结构,而Fe2+的最外层未达稳定结构,失去一个电子后成为稳定结构;
(3)根据元素周期表可知B为铝元素,根据均摊法计算晶胞中铝原子个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题主要考查了元素周期表、核外电子排布、晶胞结构等知识点,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
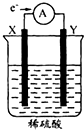 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A、外电路的电流方向为:X→导线→Y |
| B、若两电极都是金属,则它们的活动性顺序为X<Y |
| C、X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D、溶液中的SO42-向X极移动 |
巴豆酸的结构简式为CH3-CH=CH-COOH.现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
| A、只有②④⑤ | B、只有①③④ |
| C、只有①②③④ | D、全部 |
能大量共存于同一溶液中,且当改变条件使水电离的c(H+)=10-13mol/L时,一定能发生反应的离子组是( )
| A、S2-、Na+、SO32-、Cl- |
| B、Ca2+、NH4+、SO42-、SiO32- |
| C、Na+、Ba2+、Cl-、HSO3- |
| D、Al3+、Na+、SO42-、NO3- |
 砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件.
砷化镓(gallium arsenide)的化学式为GaAs,是黑灰色固体,熔点为1238℃.它是一种重要的半导体材料,用来制作微波集成电路[例如单晶微波集成电路(MMIC)]、红外线发光二极管、半导体激光器和太阳能电池等元件. 有机物M的结构简式如图所示.
有机物M的结构简式如图所示. A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体.以上物质相互间的转化关系如图所示:请回答下列问题:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体.以上物质相互间的转化关系如图所示:请回答下列问题: