题目内容
17.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用水吸收,相应的化学反应方程式为3NO2+H2O═2HNO3+NO.利用反应6NO2+8NH3$\frac{\underline{\;催化剂\;}}{△}$7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是67.2L.
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后计算标准状况下气体的体积;
(2)化学平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移12mol电子时,消耗的NO2为12÷4×22.4L=67.2L,故答案为:3NO2+H2O═2HNO3+NO;67.2;
(2)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即$\frac{a-x}{2a-x}=\frac{1}{6}$,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{C(S{O}_{3})C(NO)}{c(N{O}_{2})C(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{(\frac{4}{5}{a)}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案为:b;$\frac{8}{3}$.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学方程式的书写和氧化还原反应,及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 水是强电解质 | B. | 25℃时,纯水的pH=7 | ||
| C. | 可燃冰是可以燃烧的水 | D. | 氢氧两种元素只能组成水 |
| A. | .甲溶液含有OH- | B. | .乙溶液含有H+ | C. | 丙溶液含有HCO3- | D. | .丁溶液含有NH4+ |
| A. | pH=13的溶液:SO32-、Na+、Al3+ | |
| B. | 使甲基橙溶液变红色的溶液:Na+、SO42-、CO32- | |
| C. | 在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3- | |
| D. | 加入足量Na2O2后的溶液:K+、Cl-、ClO- |
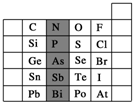 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.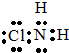 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体. 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: