题目内容
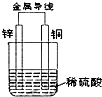 如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )| A、能将电能转换为化学能 |
| B、溶液会逐渐变为蓝色 |
| C、锌片是负极,发生氧化反应 |
| D、外电路中电子由铜片经导线流向锌片 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池是把化学能转变为电能的装置,原电池放电时,较活泼的金属作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答:
解:A、该装置是原电池,原电池是把化学能转变为电能的装置,故A错误;
B、正极上氢离子得电子生成氢气,所以铜片不参加反应,所以没有铜离子生成,故B错误;
C、该原电池中,较活泼的金属锌作负极,负极上锌失去电子发生氧化反应,故C正确;
D、电子从负极沿导线流向正极,即电子从Zn沿导线流向Cu,故D错误;
故选C.
B、正极上氢离子得电子生成氢气,所以铜片不参加反应,所以没有铜离子生成,故B错误;
C、该原电池中,较活泼的金属锌作负极,负极上锌失去电子发生氧化反应,故C正确;
D、电子从负极沿导线流向正极,即电子从Zn沿导线流向Cu,故D错误;
故选C.
点评:本题考查了原电池原理,根据原电池的定义、正负极上发生的电极反应、电子的流向和电流的流向分析解答即可,难度不大.

练习册系列答案
相关题目
分子式为C4H8O2,既能发生银镜反应,又能与金属钠反应的有机物有(不考虑立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
2003年2月1日,美国哥伦比亚号航天飞机在返回地面的途中坠毁,举世震惊,尽管科学家在探索太空的过程中遇到了挫折,但这决不会阻止人类对太空科学探究的步伐.该航天飞机用铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,点燃时,铝粉氧化放热引发高氯酸铵反应,其化学方程式可表示为:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O.下列对此反应的叙述中不正确的是( )
| A、上述反应瞬间产生大量高温气体推动飞机飞行 |
| B、该反应既是氧化还原反应也是分解反应 |
| C、上述反应过程中,旧化学键断裂所吸收的能量大于新化学键形成所释放的能量 |
| D、反应从能量变化上说,主要是化学能转变为热能和动能 |
汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液.总反应式为:Pb+PbO2+2H2SO4?2PbSO4+2H2O,关于铅蓄电池的说法正确的是( )
| A、在放电时,正极发生的反应是 Pb(s)+SO42- (aq)=PbSO4(s)+2e- |
| B、在放电时,该电池的正极材料是PbO2 |
| C、在充电时,电池中硫酸的浓度不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
 常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )
常温时,用1.0mol/L NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示.原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是( )| A、1 mol/L 60mL |
| B、0.5 mol/L 80mL |
| C、0.5 mol/L40mL |
| D、1 mol/L 80mL |
下列反应属于吸热反应的是( )
| A、碳与水蒸气制水煤气的反应 |
| B、生石灰和水的反应 |
| C、盐酸与氢氧化钠溶液的反应 |
| D、木炭在氧气中燃烧 |
化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A、用二氧化碳和环氧丙烷生产可降解高聚物有利于环境和生态 |
| B、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| C、光导纤维的主要成分不是二氧化硅而是单晶硅 |
| D、人体摄入油脂,在体内水解可得到高级脂肪酸和甘油 |