题目内容
强碱性溶液中能大量共存的离子组是( )
A、Na+、Fe2+、Cl-、SO
| ||||||
B、K+、Na+、[Al(OH)4]-、NO
| ||||||
C、Ba2+、Na+、NO
| ||||||
D、NH
|
考点:离子共存问题
专题:离子反应专题
分析:强碱性溶液中含大量的OH-,根据离子之间不能结合生成水、气体、沉淀、弱电解质等,则能大量共存,以此来解答.
解答:
解:A.Fe2+、OH-结合生成沉淀,不能大量共存,故A错误;
B.碱性溶液中该组离子之间不反应,能大量共存,故B正确;
C.因Ba2+、OH-、HCO3-结合生成水和碳酸钡沉淀,不能大量共存,故C错误;
D.因NH4+、OH-结合生成弱电解质,不能大量共存,故D错误;
故选B.
B.碱性溶液中该组离子之间不反应,能大量共存,故B正确;
C.因Ba2+、OH-、HCO3-结合生成水和碳酸钡沉淀,不能大量共存,故C错误;
D.因NH4+、OH-结合生成弱电解质,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高考常见题型,侧重复分解反应的考查,选项C中的离子反应为解答的难点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用惰性电极电解1mol/L CuSO4和0.1mol/L Cu(NO3)2的混合液100mL,当阳极析出896mL(标准状况)气体时,切断电源,若溶液仍为100mL,下列说法正确的是( )
| A、阴极析出7.04g铜 |
| B、阴极电极反应为:Cu2++2e-═Cu;2H++2e-═H2↑ |
| C、阳极电极反应为:4OH--4e-═2H2O+O2↑ |
| D、向电解后的溶液中加入铜最多溶解7.04g铜 |
若NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol氨基(-NH2)中含电子数为10NA |
| B、标况下,22.4 L N2和NO的混合气体所含的原子数为2NA |
| C、假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA |
| D、在反应CaO+3C=CaC2+CO中,生成1 mol CO,转移的电子数为3NA |
下列溶液中各微粒的浓度关系正确的是( )
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c(NH4)2SO4>c(NH4HSO4)>c(NH4C1) |
| B、向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、pH=6的纯水:c(H+)>c(OH-) |
| D、1.0mol/LNa2CO3溶液:c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) |
设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A、0.1mo1?L-1MgCl2溶液中含Cl-数为0.2 NA |
| B、1 L 0.1m01?L-1AlCl3溶液中,Al3+数为0.1NA |
| C、标准状况下,22.4L的CCl4中含CCl4分子数为NA |
| D、1mol铁与足量的Cl2反应,转移的电子数为3NA |
某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
| A、Cl-、Mg2+、H+、Cu2+、SO42- |
| B、Na+、Ba2+、NO3-、OH-、SO42- |
| C、MnO4-、K+、Cl-、H+、SO42- |
| D、K+、NO3-、SO42-、OH-、Na+ |
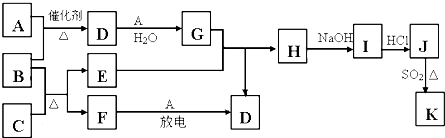
 A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.
A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.