题目内容
如图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色无味气体单质,B为具有刺激性气味的碱性气体,C为黑色氧化物,E为常见红色金属单质(部分反应的产物未列出).
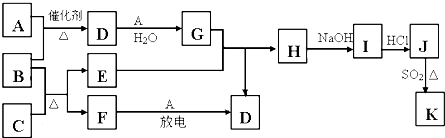
请回答下列问题:
(1)写出A的化学式 ,E的一种重要用途 ;
(2)写出B和C反应的化学方程式 ;
(3)J、K是金属E不同价态的氯化物,且K为白色沉淀是一种有特殊功能的催化剂.写出SO2还原J生成K的离子方程式 ;
(4)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:
F(g)+A(g)=2D (g)△H=+180.5kJ/mol
2C(s)+O2 (g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则上述尾气转化的热化学方程式为 .

请回答下列问题:
(1)写出A的化学式
(2)写出B和C反应的化学方程式
(3)J、K是金属E不同价态的氯化物,且K为白色沉淀是一种有特殊功能的催化剂.写出SO2还原J生成K的离子方程式
(4)汽车尾气中常含有D和CO,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:
F(g)+A(g)=2D (g)△H=+180.5kJ/mol
2C(s)+O2 (g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
则上述尾气转化的热化学方程式为
考点:无机物的推断,用盖斯定律进行有关反应热的计算
专题:推断题,化学反应中的能量变化
分析:除一种元素外,其余均为短周期元素,A、F为无色无味气体单质,B为具有刺激性气味的碱性气体,则B是NH3,C为黑色氧化物,E为常见红色金属单质,则E是Cu,C为CuO,则F为N2 ,氨气能和A发生反应,且A是无色无味的气体,则A是O2,氨气和氧气反应生成一氧化氮和水,D能和氧气、水反应生成G,则D是NO,G是HNO3,铜和稀硝酸反应生成硝酸铜和一氧化氮,则H为Cu(NO3)2,硝酸铜和氢氧化钠反应生成氢氧化铜和硝酸钠,氢氧化铜和盐酸反应生成氯化铜,则I为Cu(OH)2,J为CuCl2,氯化铜和二氧化硫发生氧化还原反应生成硫化亚铜,则K为CuCl,结合物质的性质分析解答.
解答:
解:除一种元素外,其余均为短周期元素,A、F为无色无味气体单质,B为具有刺激性气味的碱性气体,则B是NH3,C为黑色氧化物,E为常见红色金属单质,则E是Cu,C为CuO,则F为N2 ,氨气能和A发生反应,且A是无色无味的气体,则A是O2,氨气和氧气反应生成一氧化氮和水,D能和氧气、水反应生成G,则D是NO,G是HNO3,铜和稀硝酸反应生成硝酸铜和一氧化氮,则H为Cu(NO3)2,硝酸铜和氢氧化钠反应生成氢氧化铜和硝酸钠,氢氧化铜和盐酸反应生成氯化铜,则I为Cu(OH)2,J为CuCl2,氯化铜和二氧化硫发生氧化还原反应生成硫化亚铜,则K为CuCl,
(1)通过以上分析知,A是氧气,其化学式为O2,E是铜,能导电,可以做导线,
故答案为:O2;做导线;
(2)氨气和氧化铜发生氧化还原反应生成氮气、铜和水,反应方程式为2NH3+3CuO
N2+3H2O+3Cu,
故答案为:2NH3+3CuO
N2+3H2O+3Cu;
(3)二氧化硫具有还原性,能还原铜离子生成亚铜离子,氯化亚铜不溶于水,所以离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+,
故答案为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(4)①N2(g)+O2(g)=2NO (g)△H=+180.5KJ/mol
②2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
由盖斯定律,③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol.
(1)通过以上分析知,A是氧气,其化学式为O2,E是铜,能导电,可以做导线,
故答案为:O2;做导线;
(2)氨气和氧化铜发生氧化还原反应生成氮气、铜和水,反应方程式为2NH3+3CuO
| ||
故答案为:2NH3+3CuO
| ||
(3)二氧化硫具有还原性,能还原铜离子生成亚铜离子,氯化亚铜不溶于水,所以离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+,
故答案为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(4)①N2(g)+O2(g)=2NO (g)△H=+180.5KJ/mol
②2C (s)+O2 (g)=2CO(g)△H=-221.0KJ/mol
③C (s)+O2(g)=CO2(g)△H=-393.5KJ/mol
由盖斯定律,③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5KJ/mol.
点评:本题考查无机物的推断,注意以E为解答该题的突破口,结合物质的性质、反应条件、物质间的转化等来分析解答,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、标准状况下,2.24L甲醇中含有的分子数为0.1NA |
| B、1L 0.1mol/L Na2CO3溶液中,含有的CO32-数目为0.1NA |
| C、室温下,1.40g乙烯和丁烯的混合气体中含有的碳原子数目为0.1NA |
| D、标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,7.8 g苯中含有单键的数目为0.9 NA |
| B、标准状况下,2.24 L H2与O2的混合物中含有的分子数为0.1 NA |
| C、标准状况下,14g氮气含有的核外电子数为5 NA |
| D、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中氧原子数为0.3 NA |
下列化学用语正确的是( )
| A、氮气的结构式:N-N | ||
B、含有126个中子的铋原子:
| ||
C、过氧化钠电子式: | ||
D、氦原子核外电子的运动状态: |
强碱性溶液中能大量共存的离子组是( )
A、Na+、Fe2+、Cl-、SO
| ||||||
B、K+、Na+、[Al(OH)4]-、NO
| ||||||
C、Ba2+、Na+、NO
| ||||||
D、NH
|
设NA为阿伏加德罗常数.下列说法中正确的是( )
| A、1molNH4+中含有10NA个质子 |
| B、t℃时,1LpH=6的纯水中,含1×10-6 NA个OH- |
| C、78gNa2O2中含阴离子的数目为2 NA |
| D、向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为1NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol Cl2参加化学反应获得的电子数都是2NA |
| B、1mol CnH2n+2含有(3n+1)NA个共价键 |
| C、标准状况下,11.2L NO与11.2L O2混合后所含原子数为2NA |
| D、电解精炼铜时,电解池中每转移1mol电子,阳极上溶解的铜原子数为0.5NA |
 仔细观察如图两种电池的构造示意图,完成下列问题:
仔细观察如图两种电池的构造示意图,完成下列问题: