题目内容
19.下列属于碱性氧化物的是( )| A. | Ba(OH)2 | B. | Na2O2 | C. | SiO2 | D. | Fe2O3 |
分析 能与酸反应生成盐和水的氧化物为碱性氧化物,且只含金属元素、氧元素两种元素,一般为金属氧化物,但某些金属氧化物(Mn2O7、Al2O3)不是碱性氧化物,以此来解答.
解答 解:A.Ba(OH)2为碱,不是碱性氧化物,故A不选;
B.Na2O2和酸溶液反应生成盐、水和氧气,发生的是氧化还原反应,故B不选;
C.SiO2为和碱溶液反应生成盐和水,属于酸性氧化物,故C不选;
D.Fe2O3和酸溶液反应生成盐和水,属于碱性氧化物,故D选;
故选D.
点评 本题考查物质的分类,为基础性习题,把握物质的组成、碱性氧化物的判断等为解答的关键,侧重分析与应用能力的考查,注意概念的理解及应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
10.下列关于有机物的同分异构体的说法中,不正确的是(不考虑立体异构)( )
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
7.某元素最高正化合价与最低负价的绝对值之差为 4,该元素的离子跟其核外电子排布相同的离子所形成的化合物是( )
| A. | NaF | B. | CaO | C. | K2S | D. | MgS |
4.下列表示不正确的是( )
| A. | CO2的电子式: | B. | 乙炔的结构式:H-C≡C-H | ||
| C. | CH4的比例模型: | D. | Cl-的结构示意图: |
11.下列说法正确的是( )
| A. | CaCO3是共价化合物 | |
| B. | 羟基既含有共价键又含有离子键 | |
| C. | O2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | SO2是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
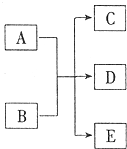 一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
 .
.