题目内容
4.氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素.请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为F>N>O.
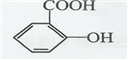
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如图1).
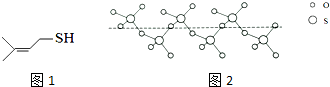
1mol3-MBT中含有σ键数目为15NA(NA为阿伏伽德罗常数的值).沸点:3-MBT低于(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是(CH3)2C=CHCH2OH分子间含有氢键,增强分子间作用力,使沸点升高.
(3)S有+4和+6两种价态的氧化物.
下列关于气态SO3和SO2的说法中正确的是AD(填选项字母).
A.中心原子的价层电子对数目相等
B.都是极性分子
C.中心原子的孤对电子数目相等
D.都含有极性键
②SO3分子的空间构型为平面三角形,与其互为等电子体的阴离子为NO3-、CO32-(举一例).将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图2,此固态SO3中S原子的杂化轨道类型是sp3.
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为Cr(填元素符号),X的基态原子的电子排布式为1s22s22p63s23p63d54s1.
(5)单质钋是由金属键形成的晶体;若已知Po的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为$\frac{1{0}^{30}M}{8{r}^{3}{N}_{A}}$g/cm3.
分析 (1)同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)每个共价键中均有一个σ键,(CH3)2C=CHCH2OH 分子中含有氢键,增强分子间作用力;
(3)①SO3中价电子对为3,没有孤对电子,为平面三角形;而SO2中价电子数为3,孤对电子数为1,为V型,据此进行解答;
②SO3的价电子对为3,没有孤对电子,为平面三角形;价电子数和原子数分别相等的是等电子体,据此写出满足条件的阴离子;图2中固态SO3中S原子形成4个共价单键;
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,则X为24号元素Cr,根据构造原理写出Cr的基态原子的电子排布式;
(5)单质钋是有金属键形成的晶体,属于简单立方堆积,一个晶胞中含有1个原子;如果原子半径为rpm,则晶胞的边长是2rpm,根据ρ=$\frac{m}{V}$计算钋晶体的密度的表达式.
解答 解:(1)与O同周期的相邻元素为N和F,同一周期元素,元素的第一电离能随着原子序数增大而增大,其中N元素的2p轨道电子处于半充满状态,稳定性较强,则第一电离能大小的顺序为:F>N>O,
故答案为:F>N>O;
(2)每个单键中均有一个σ键,双键中含有1个σ键,一个3一甲基-2-丁烯硫醇分子中共有15个共价键,则1mol 3一MBT中含有σ链数目为15NA;(CH3)2C=CHCH2OH 分子间能够形成氢键,增强分子间作用力,使沸点升高,故3-MBT的沸点低于(CH3)2C=CHCH2OH的,
故答案为:15NA;低于;(CH3)2C=CHCH2OH 分子间含有氢键,增强分子间作用力,使沸点升高;
(3)①SO3中价电子对为3,没有孤对电子,为平面三角形,而SO2中价电子数为3,孤对电子数为1,为V型,
A.根据分析可知,二者中心原子的价层电子对数目相等,都是3对,故A正确;
B.二氧化硫是极性分子,而三氧化硫为平面三角形,结构对称,为非极性分子,故B错误;
C.中心原子的孤对电子数目不等,二氧化硫分子中含有1对,三氧化硫不存在孤对电子,故C错误;
D.二氧化硫和三氧化硫都含有S与O之间的极性键,故D正确;
故答案为:AD;
②SO3分子的空间构型为平面三角形,价电子数和原子数分别相等的是等电子体,则与其互为等电子体的银离子为NO3-;CO32-;
图2中固态SO3中S原子形成4个共价单键,其杂化轨道类型是sp3,
故答案为:平面三角形;NO3-、CO32-;sp3;
(4)元素X与硒同周期,X元素原子核外未成对电子数最多,则X为24号元素Cr,Cr的基态原子的电子排布式为:1s22s22p63s23p63d54s1,
故答案为:Cr;1s22s22p63s23p63d54s1;
(5)单质钋是有金属键形成的晶体,属于简单立方堆积,一个晶胞中含有1个原子,如果原子半径为rpm,则晶胞的边长是2rpm,则钋晶体的密度的表达式为:$\frac{M}{{N}_{A}×({2r×1{0}^{-10})}^{3}}$g/cm3=$\frac{1{0}^{30}M}{8{r}^{3}{N}_{A}}$g/cm3,
故答案为:金属键;$\frac{1{0}^{30}M}{8{r}^{3}{N}_{A}}$.
点评 本题考查较为综合,涉及晶胞计算、物质结构与性质、第一电离能比较、原子杂化轨道判断等知识,题目浓度较大,注意掌握晶胞结构与应用,(1)为易错点,注意第IIA族、第VA族元素第一电离能大于其相邻元素,试题培养了学生的分析、理解能力及灵活应用能力.

 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
(1)该废氨水中氨的物质的量浓度为9×10-3 mol•L-1.
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17mg•L-1.忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为4800mol.(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO.4NH3+5O2→4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80.
①为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为89%.
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O.将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1:10,试求参加主反应的氨占原料氨的体积百分含量.
(4)废氨水可用于脱除烟气中的SO2.氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物.现称取不同质量的混合物进行实验,结果如下:
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 可逆反应向正方向进行的程度--电离常数的大小 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
 .
.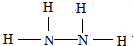 .
.
 .
. .
.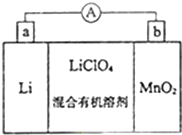 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题: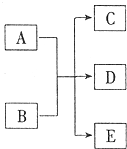 一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.