题目内容
11.25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=1000:1.分析 稀释过程中钠离子的物质的量不变,据此计算出稀释后溶液中钠离子的浓度,然后根据硫酸钠为中性可知c(OH-)=10-7mol/L,据此进行计算.
解答 解:25℃时,某Na2SO4溶液中cc(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L,但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的表达式及应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.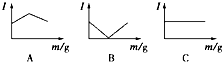 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
2.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 | |
| D. | 不同pH的溶液中有:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
6.通过对汽车尾气排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO→N2+CO2.下列关于此反应的说法中,错误的是( )
| A. | N2为还原产物 | |
| B. | 当x=2时,每生成1 mol N2,转移电子数为4 mol | |
| C. | 等物质的量N2和CO2中,共价键的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
3.下列各组烃中,所取质量一定时,无论以何样的比例混合,燃烧生成的CO2为一定值的是( )
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
20.能正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 往水玻璃中通入少量二氧化碳:SiO32-+H2O+CO2═H2SiO3↓+CO32- |
 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.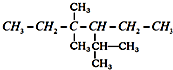 系统命名:2,4,4-三甲基-3-乙基己烷.
系统命名:2,4,4-三甲基-3-乙基己烷. 的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.
的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.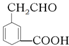 碳碳双键、醛基、羧基.
碳碳双键、醛基、羧基.